生命奥秘新解码:跨尺度生物医学成像与“数字生命”计划
信息来源:中国科学杂志社
国家重大科技基础设施“多模态跨尺度生物医学成像设施”于2025年3月21日正式通过国家验收。《中国科学:生命科学》特邀北京大学未来技术学院国家生物医学成像科学中心程和平院士、陈良怡教授、孙育杰教授、马雷研究员,国家自然科学基金委员会交叉科学部杜全生处长,北京大学基础医学院戴慧教授联合撰写“观点”文章,聚焦突破传统还原论研究范式的关键路径,深入探讨了该设施如何通过跨尺度成像技术动态关联分子活动与生理过程的核心能力,并展望了其结合人工智能(AI)构建“虚拟细胞”、发起“数字生命”大计划,以推动整合生物学发展的未来方向。
本文采用中、英文对照形式发表:
英文版请见:Trans-scale bioimaging and integrative biology: on the debut of China National Biomedical Imaging Center
中文版全文供读者阅读参考:

一、前言
在1790年的著作《判断力批判》中, Immanuel Kant指出: “生命是一个自组织、自生成的过程, 其各部分的存在与形式唯有通过它们与整体的关系才成立. 此种关系彰显有机体的统一性: 每一部分既影响整体, 亦为整体所影响, 所有部分构成一个整合的统一体.” 然而, 以如此一种全景式复杂视角, 在分成各个部分进行客观研究时面临巨大挑战.
1911年, Ernest Rutherford提出原子的行星模型, 标志着物理学中还原论(reductionism)方法的开端. 万物皆可被分解为基本粒子(标准模型), 以阐明支配它们的基本规律. James Watson与Francis Crick于1953年提出的DNA双螺旋结构模型, 成为生物学领域的一项重大突破[1]. 他们通过碱基互补配对机制, 阐释遗传信息如何在DNA中储存与复制,奠定现代分子生物学的基石. 随后, Francis Crick提出分子生物学的中心法则: 信息一旦从DNA传递至蛋白质, 便不可逆转. 通过解析DNA中编码的遗传信息, 研究者或可揭示所有生理与病理过程的根源. 这一还原论研究范式, 使得与各种生理及病理状态相关联的基因得以鉴定, 不仅推动分子生物学的兴起, 更引领对解释一切生命现象的统一的“分子机制”的探求[2].
物理学家 P.W. Anderson[3]随后指出: 能够将万物还原至简单基本定律, 并不意味着就能从这些定律出发重构整个宇宙. 当较简单的部分组合成更复杂的系统并逐级升级尺度时, 研究者在每个层级都会遇到令人着迷且根本性的新问题, 并由此发现涌现而生的全新行为或现象.
生命本身即涉及细胞内及其周围环境中各类分子在时空维度上的效应整合与相互作用. 活细胞中, 许多过程在同时发生: 基因转录为mRNA、并翻译为蛋白质, 它们共同作用于激活细胞信号通路、调节细胞代谢并介导细胞命运改变. RNA-seq, ChIP-seq和质谱等技术相继发展并完善, 得以在单细胞层面对基因组、表观基因组、转录组、蛋白组及代谢组进行测量. 近期, 技术的持续演进正推动组学测量从单细胞迈向空间跨尺度多组学时代[4]. 然而, 组学测量多在固定组织或细胞中进行, 其仅能提供静态快照. 这种情况下, 仅将分子信息叠加于静态的多尺度结构数据之上, 远不足以完全揭示生命的动态结构与功能复杂性. 另外, 成像技术——无论是荧光成像还是无标记成像——可提供组学实验中常缺位的动态信息[5]. 将动态成像与整体组学测量有机整合仍是当前重大技术挑战.
国家生物医学成像科学中心 (National Biomedical Imaging Center, NBIC)成立于2020年, 是“多模态跨尺度生物医学成像设施”的核心运行机构(图1). 该设施是“国家重大科技基础设施建设‘十三五’规划”确定的建设项目, 是我国科学家在生物医学成像领域首倡的大科学设施, 于2025年3月21日正式通过国家验收. 北京大学作为项目法人建设单位, 联合中国科学院生物物理研究所、哈尔滨工业大学, 中国科学技术大学、中国科学院物理所、中国科学院高能物理所等单位共同承担建设任务. 项目总投资为17.17亿元. 建设地点为北京市怀柔科学城核心区, 建设用地100亩, 新增建筑面积7.2万平方米. 其主体由四大核心平台与一大辅助平台构成: 包括多模态医学成像装置(装置一)、多模态活体细胞成像装置(装置二)、多模态高分辨分子成像装置(装置三)、全尺度图像数据整合系统(装置四), 以及样品制备与模式动物中心等. 该设施所实现的跨尺度(或多尺度)生物成像, 是指协调不同模态的成像策略和技术, 覆盖从纳米级(如STED、电子显微镜)到米级(如全身PET)的空间分辨率, 以及从毫秒到数年的时间分辨率, 使研究者能够将分子事件与组织器官水平的生理过程关联起来. 该设施是中国科学家通力协作、共同努力的成果, 与国际上同期启动的Euro-BioImaging及Global BioImaging等计划遥相呼应[6].
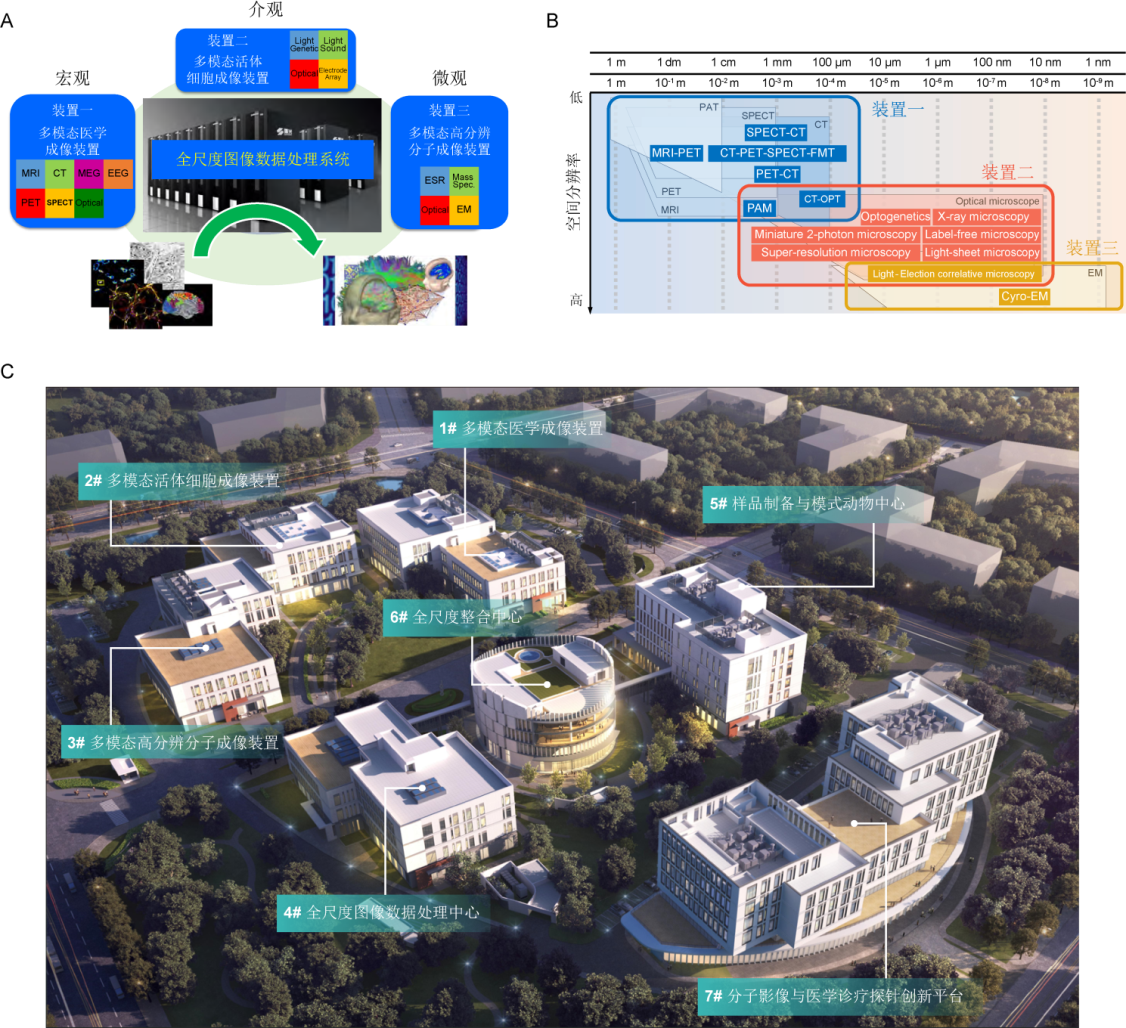
图1 多模态跨尺度生物医学成像设施. A: 技术模块; B: 空间分辨率覆盖图; C: 国家生物医学成像科学中心概览. 更多信息请访问:https://nbic.pku.edu.cn
国家生物医学成像科学中心的核心优势在于将微观、介观与宏观尺度的成像能力集于一体. 然而, 这也启发我们新的思考: 在当今组学主导的时代, 成像技术将贡献何种独特洞见? 通过运用最先进的成像模态, 实现从分子到人体的一系列成像尺度的无缝衔接, 这又能解决哪些基础科学难题? 当我们有既能获得动态成像数据, 又拥有全面的分子信息时, 应如何驾驭这日益复杂的数据洪流, 应对维度灾难, 并识别其底层基本规律?
二、生物成像的重要作用
2.1 成像提供关键的结构与定位信息
本文认为, 成像技术提供观察生命系统不可或缺的信息, 对转录组或其他分子数据形成关键补充. 在佩利措伊斯-梅茨巴赫病中(Pelizaeus-Merzbacher disease, 简称PMD, 中文可简称佩梅病), PLP1基因的不同突变导致不同的表型. 目前尚不清楚同一基因的突变如何引发不同的表型. 令人惊讶的是, 研究者在活细胞超分辨显微成像中观察到PLP1突变蛋白具有不同的亚细胞定位, 且这些定位差异与基于磁共振成像的临床分型及疾病症状的进展高度吻合[7]. 这一发现将这种无法治愈的疾病表型, 重新界定为细胞生物学中膜转运(membrane trafficking)相关的问题, 凸显亚细胞定位信息在决定细胞命运中的关键作用. 虽然突变起源于DNA/RNA层面, 其表型却受到蛋白质定位和膜转运过程的调控. 细胞器的多样形态、尺寸及其相互作用, 同样可能携带重要的信息, 这些信息不仅补充分子数据, 也助力分子的自组织, 并最终塑造细胞信号传导与细胞命运[8].
另一典型案例来自跨尺度成像对非小细胞肺癌(non-small cell lung cancer, NSCLC)中线粒体网络潜在异常的识别[9]. 利用正电子发射断层扫描(positron emission tomography, PET)成像, Han等人[9]发现在KRAS驱动的基因工程小鼠模型中, 被鉴定为肺腺癌(lung adenocarcinoma, LUAD)或肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)的NSCLC肿瘤, 对两种示踪剂——[18F]FBnTP(反映线粒体膜电位)和18F[FDG](反映葡萄糖代谢)表现出不同摄取. 当使用PET引导的micro-CT分析从样本中选定特定区域进行后续染色时, 他们发现两种不同的介观结构. 此外, 超高分辨率三维连续块面扫描电镜(3D serial block-face EM)揭示线粒体及其内嵴(cristae)的形状与分布差异, 以及它们与脂滴等其他细胞器的接触状态. 最终, 这两类细胞表现出不同的营养偏好. 在此, 研究者清晰地看到微观层面细胞器形态的精细复杂变化, 如何导致代谢活动的改变(分子/功能层面), 进而在介观层面表现为不同的病理染色特征, 最终在宏观层面形成PET-CT可监测的、不同的病理表型. 因此, 跨尺度成像对于揭示NSCLC的潜在机制至关重要, 并有望基于医学影像结果为潜在的治疗标准提供依据.
2.2 跨尺度成像揭示存在于单细胞内超越分子层面的生理机制
跨尺度成像亦能揭示器官内细胞间相互作用涌现的生理机制. 例如, 葡萄糖刺激的胰岛素的两相分泌(glucose-stimulated insulin secretion, GSIS)包含一个快速但短暂的胰岛素释放(第一相), 随后是持续1~2小时的逐渐增强的释放(第二相). 研究发现, 第一相分泌的缺失与肥胖和糖尿病中的血糖耐受性损失相关, 这突显一个亟待阐明的重要机制. Rorsman等人[10]曾在胰腺β细胞中发现一个易释放囊泡池(readily releasable pool)和一个储备囊泡池(reserved pool), 它们可能作为调控双相GSIS的功能实体. 随后, 通过还原论方法鉴定出分别负责GSIS各相的关键分子, 包括Cav1.2, CaV2.3和Munc13-1.
通过将一种细胞非渗透性锌染料与高速、高分辨率成像技术相结合, 研究者得以在单个完整胰岛内可视化观察β细胞的单个囊泡融合事件[11]. 这种跨尺度成像方法直接展示: 葡萄糖刺激会触发胰岛内单个β细胞间显著异质的分泌反应. 值得注意的是, 少数快速释放型β细胞(rapidly releasing β-cells, RRβs)贡献大部分的分泌量. 这些RRβs在时间上的同步化(synchronization)和异步化(asynchronization) 分别构成GSIS的第一相和第二相. 更为关键的是, 与胰岛内无响应的β细胞相比, RRβs在葡萄糖刺激的钙瞬变(Ca2+ transients)方面并无差异. 这一发现挑战先前通过还原论方法提出的CaV1.2和CaV2.3在GSIS中的作用[11]. 两相GSIS仅当α, β和δ细胞组装成胰岛时才得以涌现, 表明该现象并非单个细胞反应的简单加和. 以上案例表明, 跨尺度成像技术及先进的数据分析能力对于将分子置于其生理时空背景中进行解读至关重要, 从而能够揭示跨越尺度的关键生命机制.
2.3 整合生物学建模可量化并理解生命过程的基本原理
形态发生素(morphogens)是一类分泌性分子, 在塑造组织形态中扮演关键角色. 例如, 成纤维细胞生长因子(fibroblast growth factor, FGF)和骨形态发生蛋白(bone morphogenetic protein, BMP)等形态发生素调控着器官发育. Yang等人[12]研究表明, 在鸟类皮肤上, 形态发生素FGF和BMP在羽毛滤泡(follicle)在出芽(bud out)之前被激活. 这些形态发生素共同在滤泡真皮层内创建嵌套的空间域(nested spatial domains): 一个FGF活性半球状核心区和一个环绕其的BMP活性边缘区. 通过单细胞RNA测序发现, 在FGF和BMP的调控下, 中央核心区与外围边缘区之间存在数十至数百种基因表达差异. 因此, 尽管研究者已经有了大量基因层面的认识, 遗传差异如何导致核心区与边缘区结构形成受到差异性调控的机制仍然并不清楚.
利用原子力显微镜(atomic force microscopy, AFM), 他们发现中央区与周边区域的刚度特性(stiffness properties)存在差异. 他们进而开发一个弹簧-阻尼器模型(spring-and-dashpot model), 该模型定量描述由形态发生素活性所实现的黏弹性超细胞尺度响应(viscoelastic supracellular responses). 因此, 经形态发生素处理的组织发生的物理属性变化, 导致不同区域的形成, 而形成新结构的关键在于发生在超细胞尺度(supracellular scale)的作用. 与分子活力论(molecular vitalism)的认知相反, 这里不存在单一的决定性分子; 相反, 数量相对有限的潜在超细胞特性,可能为精妙调控生理变化及治疗多种疾病提供关键切入点. 这进一步凸显跨尺度成像与测量的重要性, 以及运用整合建模以获取对生物过程的定量洞察的必要性.
三、整合生物学与AI驱动的虚拟细胞模型
作为生命的基本单元, 构建一个能完全复现所有细胞功能的综合性计算细胞模型, 长期以来一直是生物学研究的“圣杯”. 随着跨尺度成像、先进组学技术的发展以及人工智能(artificial intelligence, AI)的兴起, 这一目标如今或许可以实现. 事实上, 现在或许正是开发AI驱动的虚拟细胞(AI-driven virtual cell, AIVC)模型的恰当时机——这是一种基于大型人工智能模型、具备多尺度、多模态能力的系统, 能够表征和模拟分子、细胞及组织在多种状态下的行为[13]. 若得以实现, 这一协作创新成果将为生物学和医学研究带来突破性的新能力.
然而, 开发这样能实际工作的AIVC模型面临重大挑战. 基于深度学习的基础模型必须在可解释性与产生有价值的生物学洞见之间取得平衡. 首先, 为提高模型精度, 模型中参数数量不断增加, 研究者越难以弄清参数间相关性, 模型变得愈发难以解释. 尽管深度学习模型可实现强大的预测性能, 但近期研究指出, 若无结构约束, 它们捕捉生理系统内在机制及非线性本质的能力会受到限制[13,14]. 其次, 尚不清楚如何将低维空间尺度的信息与高维尺度的信息进行整合, 因为简单地合并所有数据既可能信息过载, 也存在忽略关键信息的风险. 最后, 当前的大型基础模型训练数据通常源自高通量组学测量的静态快照数据集, 这些数据虽富含分子细节, 却缺乏时间维度信息. 相比之下, 生物成像虽能提供长期的动态数据, 但其可观测的靶标范围相对狭窄. 研究认为, AI驱动的虚拟细胞模型是迈向AI驱动的虚拟器官乃至不同生物的数字化生命形式的第一步.
为应对这些挑战, 国家生物医学成像科学中心倡导整合生物学研究范式. 这一范式强调发展动态式、全景式的先进生命测量方法, 以及从复杂非线性现象中提取信息的定量生物学技术. 我们需创新拓展生物医学成像前沿: 突破现有局限, 开发新的物理与数学原理, 融合化学知识以创造更优的成像探针. 此外, 我们致力于开发能同步获取全面分子信息与动态成像数据的方法学. 鉴于成像视场、空间与时间分辨率、通量、光毒性以及与组学方法兼容性之间存在诸多权衡取舍, 必须精心设计组合系统和实验方案, 才能实现高效数据采集.
尽管人工智能基础模型预期将发挥重要作用, 但结合物理学原理与定量建模对于揭示其背后基础的、简单的规则至关重要. Schmitt等人[14]提供一个有力例证: 他们利用三个不同的深度学习网络, 系统性地从先前已知参与调控细胞力的蛋白质图像中提取细胞力学规则. 他们推导出一个定性准确的解析公式, 其参数数量比U-net模型少105倍, 却拥有原模型77%的预测能力, 并且能推广应用于化学扰动.
将受物理学启发的机器学习与稀疏化(sparsification) 相结合, 对于推导潜在的物理原理至关重要. 在此背景下, 开发更多创新而优雅的方法来整合成像与组学测量, 为研究人员提供更广泛的技术组合选择, 以更迭代、反馈驱动的方式推进生命的定量分析. 为促进这个方向的发展, 国家生物医学成像科学中心必须投入资源以增强数据采集方法、丰富实验方案与数据收集、构建深度学习数据整合与定量生物学分析的基础设施, 并建立托管运营虚拟细胞模型的科研平台. 这正是国家生物医学科学成像中心的初心, 也是我们遴选核心人才团队的准则.
四、展望未来
本文作者期冀国家生物医学成像科学中心成为一个引领未来的平台, 拥有卓越的跨尺度成像能力, 并作为创新枢纽, 持续不断地孕育生物医学成像技术的进步. 它将会是一个综合性的科学中心, 整合成像技术与空间组学、定量生物学及系统生物学; 同时, 也将会成为一个协作网络节点, 推动国内外合作, 共同促进技术发展与科学发现. 最重要的是, 期望它成为一个前瞻性孵化器, 引领生物学研究范式的转向——迈向21世纪的新生物学: 从还原论走向整体论(holism)与涌现论(emergentism), 并具备整合性(integrative)、定量化(quantitative)与非线性(nonlinear)的特征.
凭借这样的引领性愿景以及NBIC推动技术进步的能力, 我们将与全球研究者携手, 共同构建数字细胞、数字器官乃至数字化的生命模型. 这一系列数字生命模型有望深刻重塑现代生物学与精准医学研究的格局. 最终, 我们或许终能解答那个萦绕数个世纪的问题——“何为生命? ”——它最初由伟大的古希腊哲学家Aristotle在《论灵魂》(De Anima)中提出, 后来又经20世纪物理学家、量子理论奠基人之一Erwin Schrödinger在其著作《生命是什么?》(What is Life?)中深入探讨[15]. 唯有达成此目标, 我们方能认识到: 生物学绝非屈从于物理学、化学等学科的附属应用科学, 而是与它们彼此平等、互为启迪. 这些学科携手并进, 深化我们对生物复杂性及全球健康内涵的理解. 这一共识蕴含着我们与地球和谐共生的美好愿望[2].
【参考文献】
[1] Watson J D, Crick F H C. Molecular structure of nucleic acids: a structure for deoxyribose nucleic acid. Nature , 1953 , 171: 737 -738
[2] Woese C R. A new biology for a new century. Microbiol Mol Biol Rev , 2004 , 68: 173 -186
[3] Anderson P W. More is different. Science , 1972 , 177: 393 -396
[4] Bressan D, Battistoni G, Hannon G J. The dawn of spatial omics. Science , 2023 , 381: eabq4964
[5] Strack R. Imaging across scales. Nat Methods , 2023 , 20: 1870
[6] Pfander C, Bischof J, Childress-Poli M, et al. Euro-BioImaging—interdisciplinary research infrastructure bringing together communities and imaging facilities to support excellent research. iScience , 2022 , 25: 103800
[7] Xing S, Zheng X, Yan H, et al. Superresolution live-cell imaging reveals that the localization of TMEM106B to filopodia in oligodendrocytes is compromised by the hypomyelination-related D252N mutation. Sci China Life Sci , 2023 , 66: 1858 -1868
[8] Rafelski S M, Marshall W F. Building the cell: design principles of cellular architecture. Nat Rev Mol Cell Biol , 2008 , 9: 593 -602
[9] Han M, Bushong E A, Segawa M, et al. Spatial mapping of mitochondrial networks and bioenergetics in lung cancer. Nature , 2023 , 615: 712 -719
[10] Rorsman P, Eliasson L, Renström E, et al. The cell physiology of biphasic insulin secretion. Physiology , 2000 , 15: 72 -77
[11] Peng X, Ren H, Yang L, et al. Readily releasable β cells with tight Ca2+-exocytosis coupling dictate biphasic glucose-stimulated insulin secretion. Nat Metab , 2024 , 6: 238 -253
[12] Yang S, Palmquist K H, Nathan L, et al. Morphogens enable interacting supracellular phases that generate organ architecture. Science , 2023 , 382: eadg5579
[13] Bunne C, Roohani Y, Rosen Y, et al. How to build the virtual cell with artificial intelligence: priorities and opportunities. Cell , 2024 , 187: 7045 -7063
[14] Schmitt M S, Colen J, Sala S, et al. Machine learning interpretable models of cell mechanics from protein images. Cell , 2024 , 187: 481 -494.e24
[15] Schrödinger, E. (1945). What is life? The Physical Aspect of the Living Cell (Cambridge: University press).




