陈良怡组开发活细胞定量高保真超分辨率方法
(信息来源:陈良怡教授团队)
2023年5月30日,北京大学未来技术学院陈良怡课题组在Nature Communications杂志发表了一篇题为“Quantitative structured illumination microscopy via a physical model-based background filtering algorithm reveals actin dynamics”的研究论文。在该研究中,通过仔细研究结构光显微镜的成像过程,课题组提出了基于物理成像模型的区分焦内信号和焦外背景算法,成功去除了背景荧光。进一步加入之前的稀疏解卷积算法后,实现了优于70nm分辨率的同时保留了荧光弱信号的完整性以及重建信号的线性度,从而实现了活细胞定量高保真超分辨率成像。相关论文链接见: https://www.nature.com/articles/s41467-023-38808-8.
如何在提高SIM时空分辨率、消除噪声与伪影的同时,保持成像结构的完整性一直是超分辨成像的一个核心问题。2018年,该课题组发现SIM在执行Wiener解卷积时容易受到随机噪声放大的干扰。为了解决这个问题,他们提出利用生物样本的时空连续性先验来减小噪声伪影的方法。2022年,课题组利用荧光图像的稀疏性作为另一种通用先验知识,开发了稀疏解卷积算法(sparse deconvolution)。这一算法从数学角度出发,提高了光子数-分辨率的转化效率,进一步提高了活细胞超分辨成像的时空分辨能力,实现了采样率为564Hz、分辨率小于70nm的超分辨率成像。
然而,尽管稀疏解卷积显著提高了分辨率和对比度,课题组发现时空连续性先验在处理部分Wiener-SIM的SR成像图像后出现了周期性伪影。这是因为周期性伪影也满足时空连续性和稀疏性的先验知识,因此如果这些伪影没有被Wiener重建完全消除,随后的稀疏解卷积会放大这些伪影。而这些显著的周期性伪影是由高强度或者是分布不均匀的背景荧光引起的。在Wiener-SIM重建时,低频背景信号被错误地移频到高频分量中,从而导致周期性伪影。为解决这个问题,目前有两种思路:一种是直接从原始图像中分离背景荧光分量;另一种是使用陷波滤波器的方式滤除频谱中特定频率分布的频谱分量。然而,这两种方法均面临挑战:从原始图像中分离背景需要避免超分辨重建时弱信号被消除;而使用陷波滤波器的方法(如NF-SIM、HiFi-SIM)对不同细胞器的图像需要经验性地调整参数,即使这些图像使用相同的显微镜系统参数拍摄。此外,这两种方法都可能会引入信号强度的非线性变化,使荧光信号的解释变得复杂。
针对这些问题,他们提出定量化高保真活细胞超分辨成像的四个标准如下:
1) 透明性和可重复性:确保在相同参数下不同研究者都能获得相同的结果;
2) 最小化(或消除)重建伪影和错觉:确保重建结构的准确性和可靠性;
3) 空间分辨率与荧光结构完整性间的平衡:高效的超分辨方法应在保持弱信号的同时提供高分辨率;
4) 重建后荧光信号线性度不变:强调准确定量化荧光信号的重要性。
为了解决这些问题,研究者们提出了基于物理成像模型的方法,去除背景而不影响真实信号。由于相机拍摄的图像是由不同样本深度激发的荧光与相应点扩散函数(PSF)的卷积叠加所得,因此可以考虑分离卷积后的焦内信号与焦外背景(如图1)。借助焦内的样本分布![]() 来近似焦外的样本分布
来近似焦外的样本分布![]() ,研究者们得到了一个新的SIM成像模型:
,研究者们得到了一个新的SIM成像模型:
![]()
其中,![]() 是正弦照明模式,
是正弦照明模式,![]() 和
和![]() 分别为焦内范围和焦外范围内的PSF。
分别为焦内范围和焦外范围内的PSF。
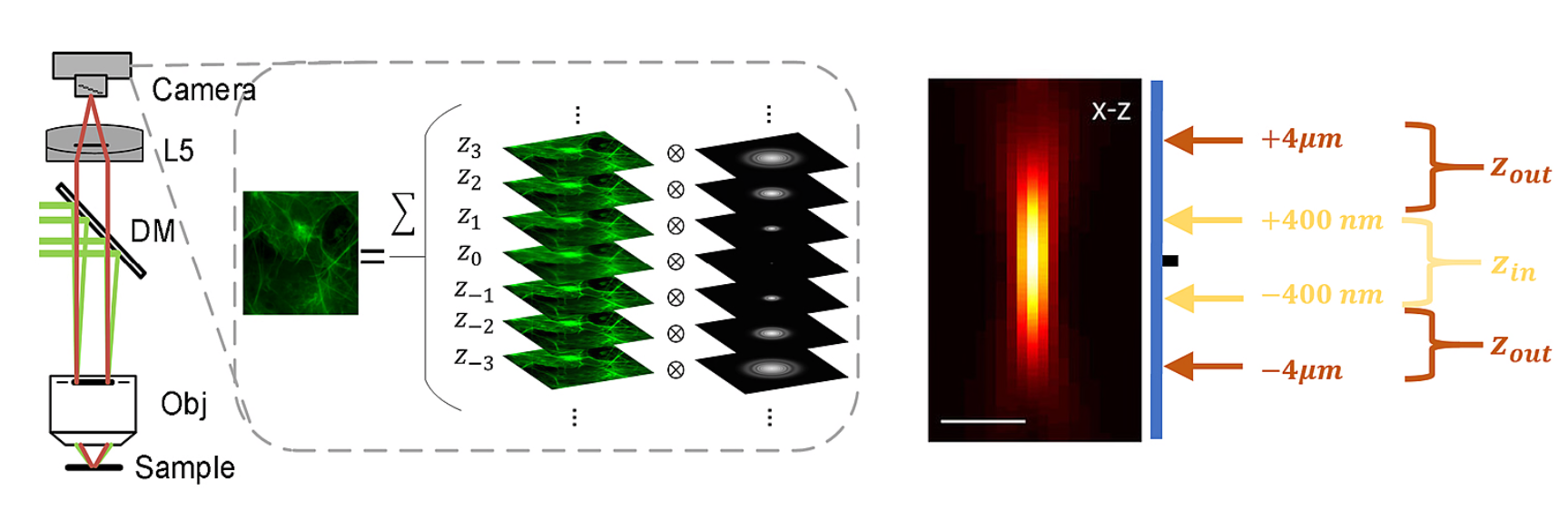
图1. SIM原始图像来源于不同深度的荧光叠加,以及沿轴向的模拟点扩散函数(PSF) 剖面的焦内和焦外的区分示意图
通过引入这种新的背景滤波(BF)方法,BF-SIM成功地消除了actin频谱中的错误特征分量,并减轻了Wiener-SIM和Sparse-SIM图像中的周期性伪影。此外,与Wiener-SIM和HiFi-SIM相比,BF-SIM的性能更优,可以获取更高对比度的超分辨肌动蛋白纤维图像,同时对肌动蛋白微丝弱信号的检测也更为可靠(见图2)。另一方面,BF-SIM重建的脂滴SR图像的线性度与Wiener-SIM相当,优于HiFi-SIM(图2)。
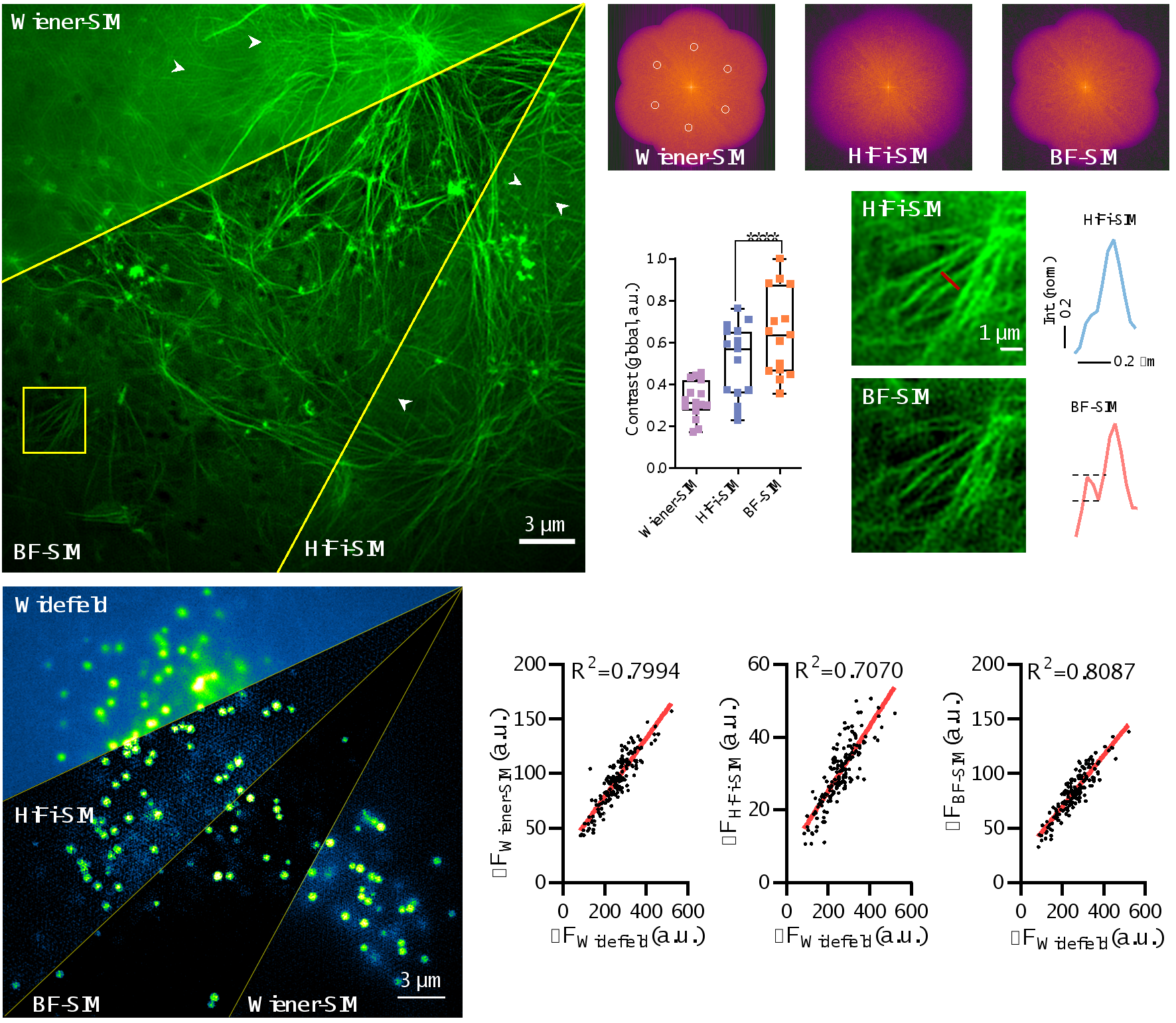
图2.BF预处理能够去除频谱中的错误特征点,抑制固定模式的伪影,并且保持弱信号的完整性。同时,BF-SIM重建信号的线性度优于HiFi-SIM
最后,论文使用了密集标记的肌动蛋白网状结构,来比较BF-Sparse-SIM与采用小波消除背景的Sparse-SIM(Wavelets-Sparse-SIM)的性能(见图3,视频1)。尽管这两种处理方法都能实现优于70nm的分辨率,但BF-Sparse-SIM在肌动蛋白纤维荧光强度的波动方差上仅为Wavelets-Sparse-SIM的一半至四分之一,这表明BF-Sparse-SIM在弱信号处理上具有更高的连续性。同时,在对BF-Sparse-SIM的超分辨图像进行骨架化处理后,测量到的肌动蛋白纤维密度和平均长度分别是Wavelets-Sparse-SIM的1.5倍和2.5倍。
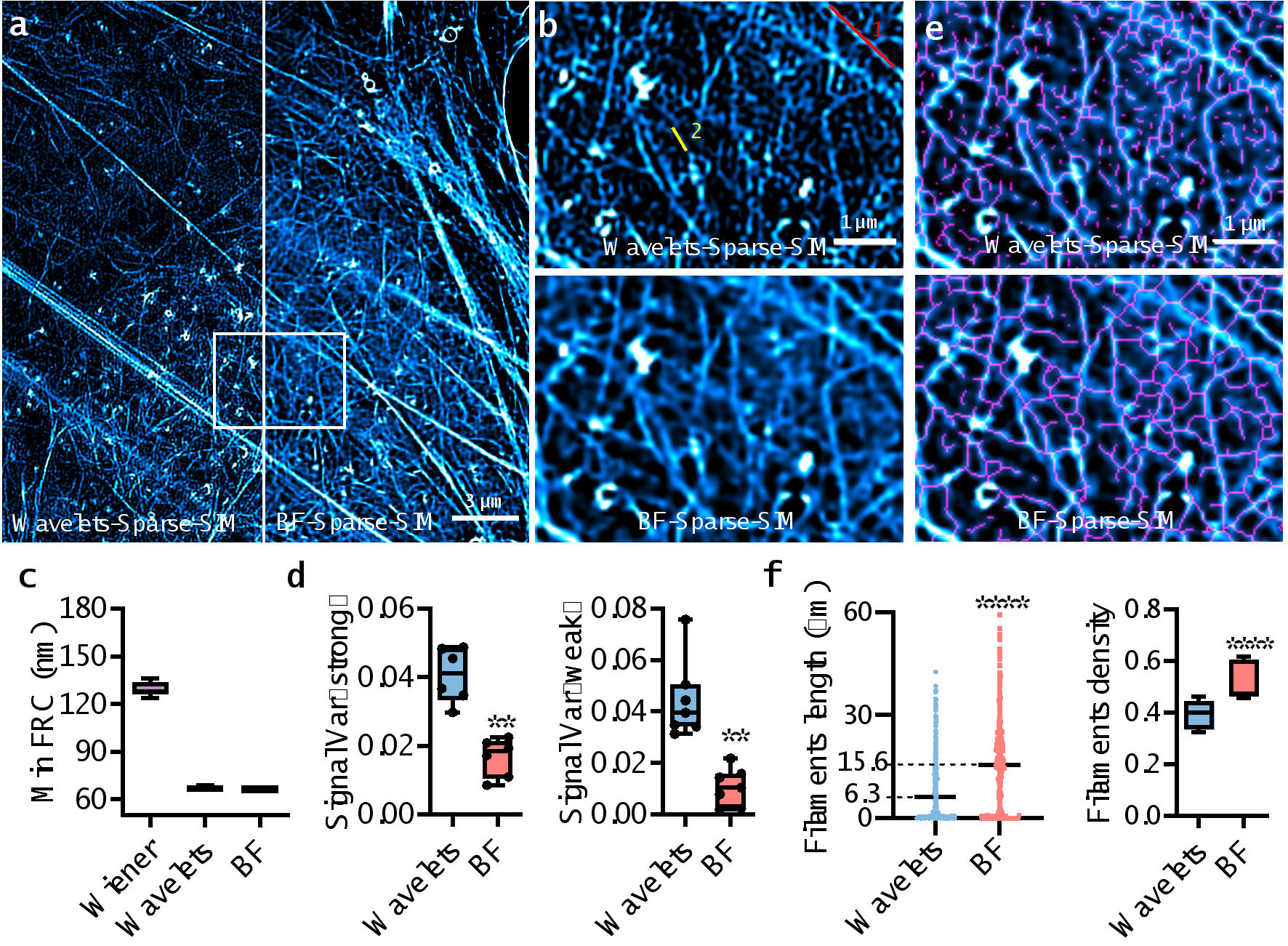
图3. BF-Sparse-SIM比Wavelets - Sparse –SIM具有更高保真度和更完整结构的肌动蛋白网络
视频1. BF-Sparse-SIM与Wavelets - Sparse -SIM对密集标记的actin的重建对比
得益于定量化高保真的BF-Sparse-SIM,本论文在RAW 264.7细胞表面发现了三种新型肌动蛋白丝局部动力学过程(见图4)。1)“Actin blip”,出现在肌动蛋白网络的节点,分布面积较小,荧光强度迅速上升后快速下降;2)“Actin cloud”,起始于一个肌动蛋白聚集点,逐渐吸引更多肌动蛋白,随后荧光信号缓慢沿着细胞骨架扩散。Actin cloud分布面积较大,荧光强度上升和衰减过程也较为缓慢。在某些情况下,部分Actin cloud事件在荧光强度达到最大值时会出现一个平台期,然后才开始缓慢衰减。3)“Actin vortex”,外圈荧光先变亮,然后以涡旋状方式由外向内逐渐变亮,接着在荧光强度达到最大值后,荧光逐渐衰减。有意思的是,一半的Actin vortex事件具有两个荧光增强速率:先经历缓慢上升阶段,然后经历快速上升阶段。
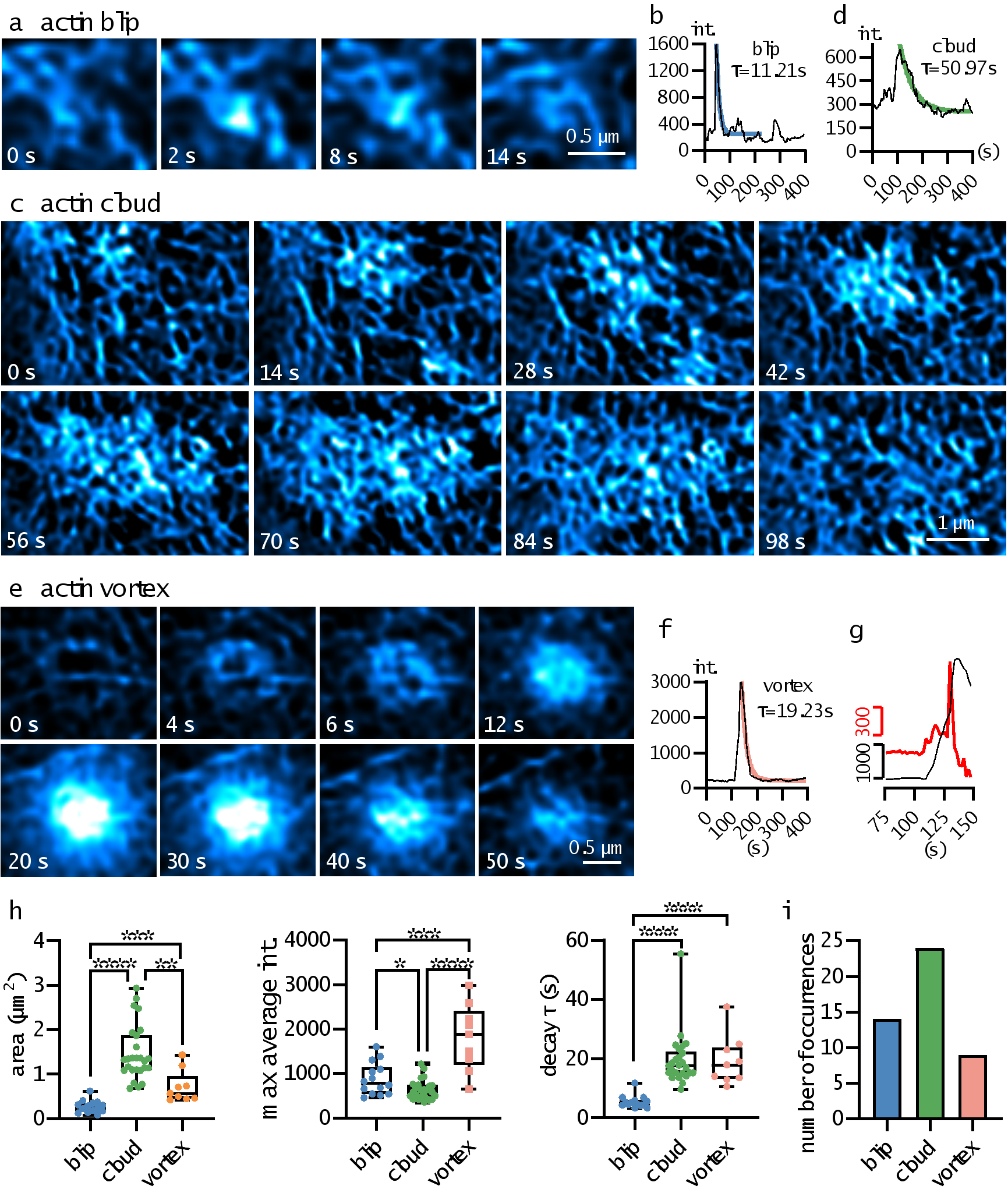
图4.三种新型肌动蛋白丝局部动力学过程的分布样例及其荧光随时间变化曲线,以及局部动力学过程相应的分布面积、平均荧光信号峰值、荧光衰减时间常数、发生频次等参数统计结果
总之,本文提出了一种基于物理模型的背景滤波方法,它在通过Sparse解卷积提高分辨率的同时,有效地降低伪影,确保信号线性和结构完整性。
北京大学未来技术学院的博士研究生莫燕权为本论文的第一作者,北京大学未来技术学院的陈良怡教授和重庆邮电大学的范骏超副教授为论文的共同通讯作者。该研究还得到华南师范大学的王昆浩及北京大学未来技术学院的李柳菊、邢诗嘉等人的帮助。该项目的数据处理获得了北京大学未名超算平台的硬件和技术支持。该课题得到国家自然科学基金,国家科技部基金以及生命科学联合中心等经费支持。
参考文献
1.Huang, X. et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nat. Biotechnol.36, 451–459 (2018).
2.Zhao, W. et al. Sparse deconvolution improves the resolution of live-cell super-resolution fluorescence microscopy. Nat. Biotechnol.40, 606–617 (2022).
3.Müller, M., Mönkemöller, V., Hennig, S., Hübner, W. & Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nat. Commun.7, 10980 (2016).
4.Wicker, K., Mandula, O., Best, G., Fiolka, R. & Heintzmann, R. Phase optimisation for structured illumination microscopy. Opt. Express21, 2032–2049 (2013).
5.Wen, G. et al. High-fidelity structured illumination microscopy by point-spread-function engineering. Light. Sci. Appl.10, 70 (2021).
6.Mo, Y. et al. Quantitative structured illumination microscopy via a physical model-based background filtering algorithm reveals actin dynamics. Nat Commun14, 3089 (2023).




