陈良怡团队开发超分辨尺度的原位成像质量评估工具
信息来源:陈良怡教授团队
2023年12月14日,北京大学陈良怡团队与哈尔滨工业大学赵唯淞/李浩宇团队合作 Light: Science & Applications (IF:20.3)上发表论文 Quantitatively mapping local quality of super-resolution microscopy by rolling Fourier ring correlation 。他们提出可以利用滚动傅里叶环相关(rolling Fourier ring correlation, rFRC)方法来评估超分辨尺度下的重建不确定度。同时将 rFRC 方法与改进的分辨率比例误差图(Resolution scaled error map, RSM)相结合,提出了一种像素级误差量化方法(Pixel-level analysis of error locations, PANEL),能够通用、无参考地生成超分辨尺度下像素级误差定量图,为生物分析精确定位可靠性较低的区域,判定精度最高可提升10倍。此外,rFRC 可精确比较不同单分子定位显微镜(Single-molecule localization microscopy, SMLM)恢复算法的性能,促进了超分辨尺度下不同重建图像的有效融合,最大限度降低了潜在误差,实现了大视场单分子定位纳米级极限空间分辨成像。团队提供了rFRC完备的MATLAB和Python开源代码,以及开箱即用的Fiji/ImageJ插件,使得其能够与多种模态光学(超分辨)成像技术结合,成为一种易于使用的本地质量评估工具。

通过设置荧光探针或结合物理的受激辐射现象,超分辨荧光显微镜已经突破了分辨率的物理衍射极限(200~300纳米)。然而,超分辨显微镜对样本的超分辨信息提取能力,往往依赖于图像的计算重建与后续处理,而化学环境和光学设置等因素会在重构中对图像产生影响,造成噪声与失真,降低超分辨图像质量。因此,对超分辨图像进行精确可靠的质量评估,可有效的量化误差和不确定性,从而进一步分析生命科学问题。尽管目前已有几种方法可对超分辨图像质量进行评估,但还无法在超分辨尺度上进行超精密且无参考的量化分析,且难以准确评价图像分辨率分布的异质性。
为解决上述问题,陈良怡团队针对图像的像素级细小误差,采用滚动傅里叶环相关计算在超分辨尺度上进行量化和估计。与此同时,对于较大的结构失真等错误,引入改进的分辨率比例尺误差图(RSM),最终构成一套完善的超分辨尺度显微图像重建质量评估方案(Pixel-level ANalysis of Error Locations-PANEL,像素级图像误差定位分析)。利用该项技术可以精确比较不同单分子定位显微镜重建算法的性能,并进一步促进超分辨率尺度下不同重建图像的有效融合,最大限度降低了潜在误差。此外,该方法还能够与目前常用的多种模态光学超分辨显微成像技术结合,成为一种易于使用的图像局域质量评估分析工具。
研究者利用单分子定位微管数据集对提出的评估方法进行了验证(图1)。通过大视场STORM获得的超分辨微管二维图像显示,细丝交叉点和细胞核周区域的分辨率,因射体聚集和失焦效应而明显较低(图1左)。细胞骨架呈现由核周区域至外围区域逐渐稀疏的特点从图中给出的不确定量化评价和分辨率分布地图,证明该方法成功绘制出微管密集程度变化引起的分辨率异质性(图1右)。利用该方法可以有效评估单分子定位显微镜(STORM)分辨率异质性。
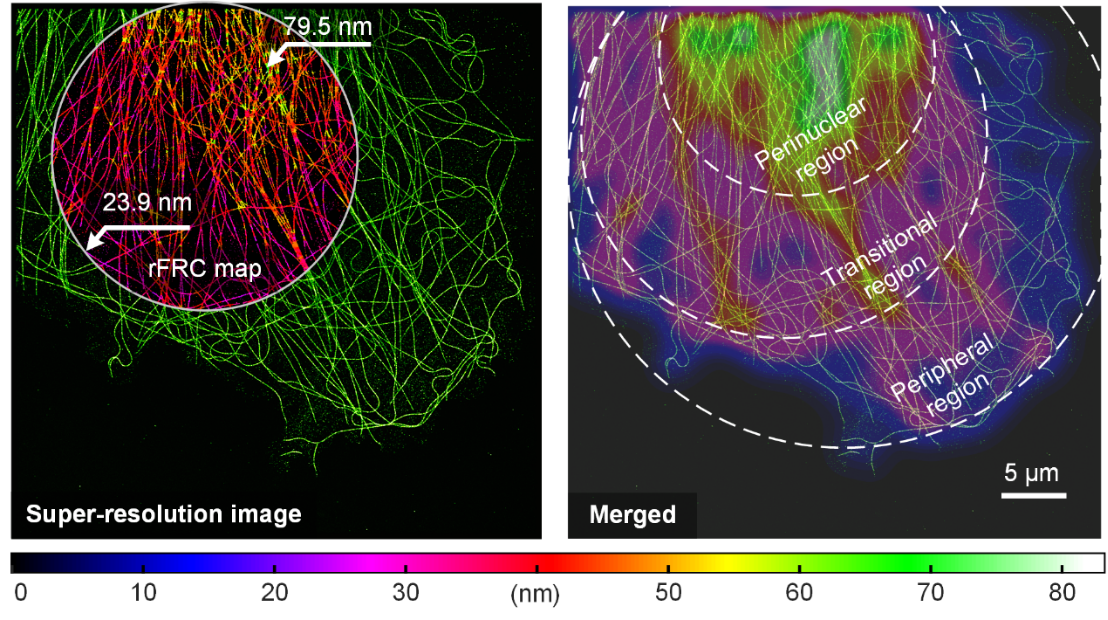
图1 | rFRC 评估定位显微镜的超分辨率图像。左图:COS-7 细胞中用 Alexa Fluor 647 标记的 α-微管蛋白的 STORM 重建结果及其rFRC 图。右图:STORM 结果(亮绿色)和高斯平均 rFRC 图(shifted jet图)的合并视图,用于突出显示低质量区域。比例尺:5 μm
PANEL因其原理通用性可广泛应用于评估其他模态的超分辨技术。研究团队将Hessian 去噪算法应用于Wiener-SIM重建(图2a)以获得Hessian-SIM图像(图2b)。与两张图像相等的RSM值(RSM值:0.27与0.27)相比,rFRC 值准确反映出Wiener-SIM和Hessian-SIM之间在保真度上的细微差异(rFRC 值:1.36与1.24)(图2c)。此外,rFRC 还可用于确定Richardson-Lucy(RL)解卷积算法的迭代次数。研究者应用RL解卷积处理TIRF图像(图2d),并计算每次迭代的相应rFRC值(图2e,2g)。分析rFRC随迭代次数的变化特性,可确定RL解卷积迭代重建次数,获得最佳的重建效果。
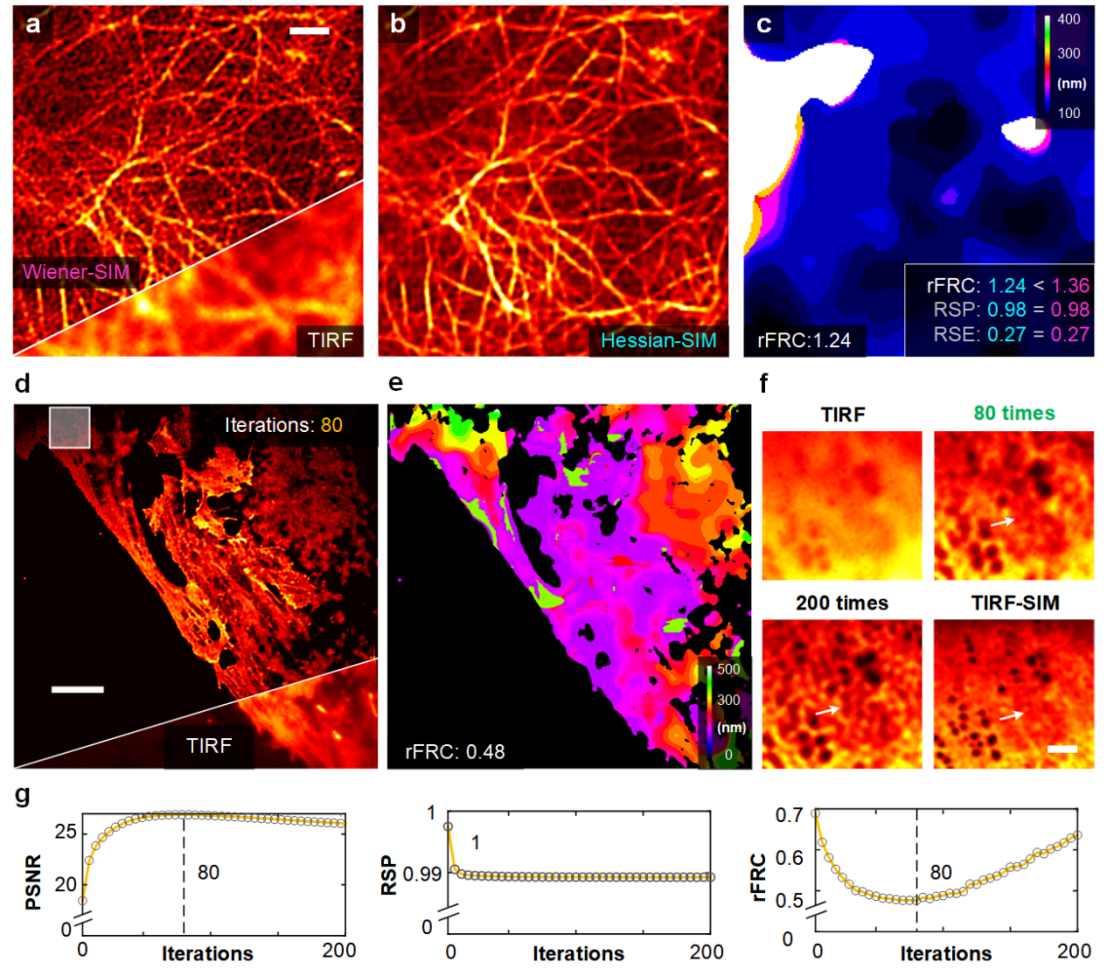
图 2 | rFRC 图辅助和评估了多种光学成像方法。(a) 在 Wiener-SIM(顶部)和 TIRF(底部)成像下用 LifeAct-EGFP 标记的活人脐静脉内皮细胞 (HUVEC) 的代表性图像。(b) Hessian-SIM 结果。(c) Hessian-SIM 的 rFRC 图。Wiener-SIM(洋红色)和 Hessian-SIM(青色)的 rFRC、RSP 和 RSE 值显示在右下角。(d) 在 RL 去卷积(顶部)和 TIRF(底部)成像下用 DiI 标记的固定肝窦内皮细胞 (LSEC) 的代表性结果。(e) RL 反卷积结果的 rFRC 图。(f) (d) 中白框的放大视图。原始 TIRF 图像、80 次和 200 次迭代的 RL 反卷积结果以及 TIRF-SIM 结果分别显示在左上、右上、左下和右下。(g) 迭代过程中的 PSNR(相对于 TIRF-SIM)、RSP(相对于 TIRF)和 rFRC 值的曲线。比例尺:(a) 1 μm; (d) 5 μm; (f) 100 nm
总的来说,rFRC与PANEL 技术揭示了图像空间信息的不确定性,不仅为基于超分辨图像的生物分析提供了重要支持,并有可能推动计算显微成像领域的进一步发展。研究者们期望 PANEL 可以广泛用作跨模态工具,成为广泛应用的生物分析方法,为超分辨显微技术的创新提供有力工具,推动计算显微镜领域获得更大的进步。陈良怡团队已经发展多种计算超分辨成像技术(Nature biotechnology, 2022 ; Nature Photonics, 2023),PANEL将支持现有的计算超分辨成像技术,形成真正的定量化与可复现性。
哈尔滨工业大学赵唯淞助理教授为论文第一作者,哈尔滨工业大学李浩宇教授和北京大学国家生物医学成像科学中心陈良怡教授为论文的通信作者。其中,论文共同第一作者还包括北京大学黄小帅助理教授和南开大学杨建宇博士后,共同通信作者还有南开大学潘雷霆教授和北京大学赵士群特聘副研究员。哈尔滨工业大学谭久彬院士为论文共同作者。
原文链接:https://doi.org/10.1038/s41377-023-01321-0




