陈知行课题组与德国合作者研发新探针实现对固定细胞线粒体的STED成像
信息来源:陈知行教授课题组
2024年4月30日,北京大学未来技术学院、国家生物医学成像科学中心、北大-清华生命科学联合中心陈知行课题组与德国科隆大学合作,在Proc. Natl. Acad. Sci.U.S.A.杂志上发表了题为“An Aldehyde-crosslinking Mitochondrial Probe for STED Imaging in Fixed Cells” 的研究论文。该研究报道了一款适用于STED显微镜的线粒体内嵴染料PK Mito Orange Fix(PKMO FX),其不仅能实现对活细胞线粒体的STED成像,在细胞经过甲醛或戊二醛等常用醛类固定液固定后,依然能高效保留线粒体荧光,实现对固定细胞的线粒体STED成像(图1)以及光电联用线粒体超分辨成像(STED-CLEM)。
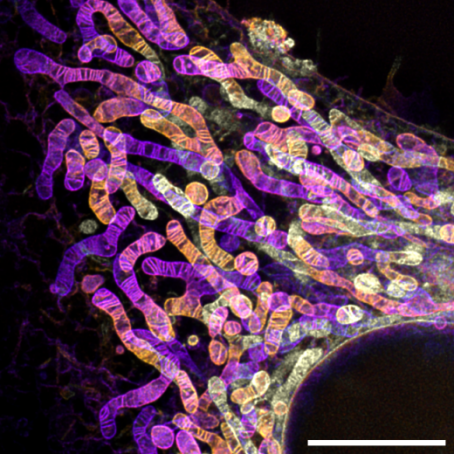
图1. PK Mito Orange Fix标记的HeLa细胞经戊二醛固定后的线粒体多层STED成像。比例尺:5μm。
陈知行课题组在过去几年的时间里研发了PKMito系列线粒体内嵴超分辨探针(PNAS 2022 cover story, ChemSci 2020),在国内外得到了广泛的应用。德国科隆大学细胞成像平台Christian Jüngst博士自2022年起就利用PKMitoOrange探针支持了多个线粒体、衰老等方向的前沿课题(Nat. Commun. 2022, 6704)。Jüngst博士与陈知行课题组经常进行讨论,提出了一个设想:活细胞线粒体染料经过固定之后往往丧失大部分线粒体定位。能否设计一款能够在固定后仍可以进行STED内嵴成像?这样可以兼容其他的固定细胞荧光标记策略,还可以方便保存更多细胞生物学实验室的样品,利于超分辨显微成像的进一步普及。
线粒体探针大多依赖于线粒体膜电位(MMP)来驱动带一个带正电的分子特异性定位线粒体。虽然这些探针在活细胞成像时表现良好,但当细胞固定时,线粒体MMP快速改变,非共价的线粒体探针会迅速扩散出线粒体,随之沾染在附近的脂质结构如内质网上,导致固定细胞线粒体成像一直存在亮度低、信噪比差等问题。长期以来,发展可固定的线粒体探针的思路是在探针上偶联一个可以与蛋白质的亲核残基反应的活性基团,例如目前最常用的可固定线粒体染料MitoTracker系列采用苄氯与蛋白的Cys反应,形成共价连接。然而,受限于蛋白与染料低的共价交联效率,这些染料在固定后的成像效果并不尽人意。且随着超分辨显微成像的发展,诞生于上个世纪的MitoTracker系列染料的光学性质已经不能满足STED成像的需求,在活细胞STED成像上表现不佳,更难用于固定细胞STED成像。
该研究在课题组之前关于PK Mito Orange研究的基础上,沿用Cy3.5这一适用于线粒体STED成像的染料母核,进一步发展可固定的线粒体探针。作者首先在Cy3.5上偶联一些常用的共价反应基团,如苄氯、NHS酯等,得到的可共价探针在细胞固定后效果欠佳。于是作者转变思路,将伯胺偶联在Cy3.5上,虽然末端为氨基的Cy3.5在活细胞染色时不能与蛋白共价交联,但在加入醛类固定液后可基于胺与醛的快速缩合反应,实现蛋白-染料-固定液之间的高效交联。作者将该探针命名为PKMO FX,这种策略也被称为“固定驱动的化学交联”(图2)。
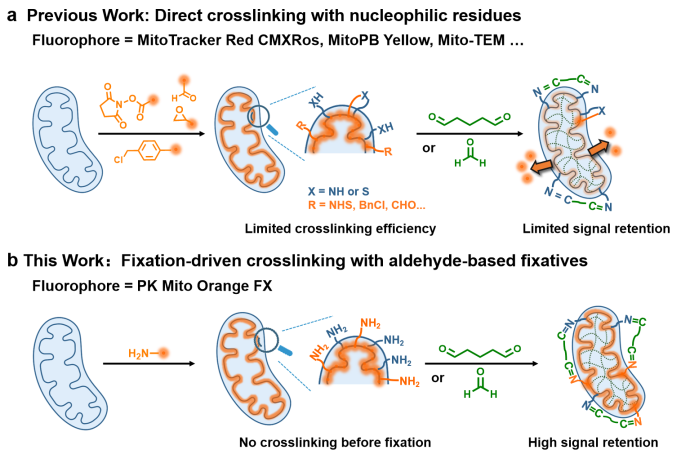
图2. PKMO FX探针与传统可固定线粒体探针采用不同的交联策略。
作者首先比较了各种可固定染料在固定前后线粒体的荧光保留率和图像信噪比,PKMO FX表现最优,此两项性能上均有大幅提升。随后作者展示了细胞经PKMO FX染色、醛类固定液固定后的线粒体STED成像图,图像可见清晰的线粒体内嵴,分辨率低至约70 nm。多层层扫STED成像展示了线粒体在Z方向上形态的多样性。PKMO FX也适用于包括癌细胞、心肌细胞、神经元、以及蛋白缺陷型细胞在内的多种细胞系的超分辨成像。
进一步地,作者将PKMO FX与其他多种兼容固定的标记方法联用,包括表达荧光蛋白、自标记蛋白标签、共染其他可固定染料、代谢标记以及免疫荧光标记,实现对细胞的多种细胞结构的固定后多色成像(图3)。
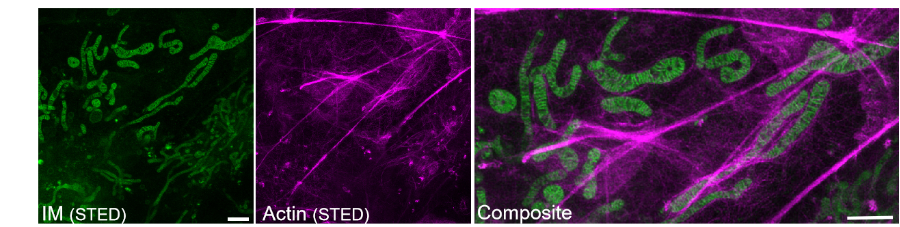
图3. PKMO FX探针标记的线粒体内嵴与免疫标记的Actin。比例尺:1 μm。
最后,作者将PKMO FX用于光电镜联用(CLEM),在电镜成像图上“点亮”线粒体超微结构。进一步地,用SYBR Gold 染色的mtDNA与PKMO FX染色的线粒体内嵴实现了双色CLEM,以高的定位精度在电镜图上标记了mtDNA。实验表明mtDNA主要分布在线粒体嵴内大的空腔处,这是单独使用EM难以观测到的。线粒体信号架起了其他荧光通道与电镜图像的桥梁,有望成为CLEM领域的新工具。

图4. PKMO FX探针实现线粒体内嵴与mtDNA的双色光电联用成像。比例尺:3μm。
综上,作者采用了一种新的生物偶联策略,开发出了一种兼容固定细胞STED成像的新型线粒体探针。PKMO FX既具有优良的光学性质,又能在固定后保持强线粒体荧光,首次实现了仅通过小分子染料实现对固定细胞线粒体内嵴超微结构的可视化。
北京大学未来技术学院2020级博士生陈婧婷为本文第一作者。北京大学未来技术学院、国家生物医学成像科学中心、北大-清华生命科学联合中心研究员陈知行和德国科隆大学的Christian Jüngst为本文的共同通讯作者。此外,本工作还得到了哥廷根大学/马克斯·普朗克研究所Stefan Jakobs课题组的合作支持。陈知行课题组2018年建立以来一直致力于研发新型荧光探针,努力打造国际领先的系列尖端成像试剂,助力细胞生物学与未来成像技术的交叉融合与协同发展。




