陈匡时课题组揭示RNA支架调控HIV病毒与类病毒颗粒的组装行为
信息来源:陈匡时教授课题组
近日,北京大学未来技术学院、国家生物医学成像科学中心陈匡时课题组在Science Advances上发表题为Roles of RNA scaffolding in nanoscale Gag multimerization and selective protein sorting at HIV membranes的研究论文,通过单分子定位显微成像技术解析了HIV病毒颗粒与类病毒颗粒(virus-like particles, VLPs)在纳米尺度下的组装行为,发现两种颗粒具有不同的组装机制,而不同的组装模式也对后续HIV病毒包膜招募细胞膜蛋白过程造成影响。文章链接:https://www.science.org/doi/10.1126/sciadv.adk8297
Gag是包括HIV在内的逆转录病毒的组装结构蛋白,同时也是RNA 结合蛋白,即能与病毒RNA(gRNA)结合组装形成约直径150 nm的病毒颗粒,也能与细胞自身的mRNA(cellular mRNA)结合组装形成具有类似大小与形状的类病毒颗粒(VLPs)。迄今为止,已有大量生化以及传统荧光显微成像研究表明这两种颗粒的组装是Gag以RNA为支架(scaffold)在细胞膜上发生高程度的Gag-Gag多聚化,进而形成紧密的组装平台的结果。但是这些发现无法解释为何在被HIV病毒感染的细胞中Gag对gRNA的结合与包装具有倾向性。陈匡时课题组长年通过分子定位显微成像技术研究病毒组装【 Proc Natl Acad Sci U S A . 2014, 111(26):E2676-83; Proc Natl Acad Sci U S A. 2017, 114(47): E10056-E10065; Proc Natl Acad Sci U S A. 2018, 115(26), 6721-6726; Protein Cell . 2018, 9(7): 640–651; ACS Nano. 2021,15(9), 14338-14346; Nucleic Acids Res. 2022, 50(8): e44】。在本研究中,课题组通过空间分辨率可达约20 nm的单分子定位显微成像技术对这两种颗粒在纳米尺度下进行了固定细胞以及活细胞成像(图1)。固定光激活定位显微成像技术(photoactivated localization microscopy, PALM)成像与聚落分析结果发现Gag蛋白在包装gRNA时蛋白密度较高,且其包装过程中Gag-RNA、Gag-Gag的相互作用具有协同效应。与之相比,细胞RNA介导形成的Gag蛋白聚落的平均蛋白密度更低、并且Gag-RNA 与Gag-Gag的互作没有显著的协同性。活细胞PALM成像与Time-correlated PALM (tc-PALM)、HMM-Bayes算法分析结果显示相较于包装gRNA,Gag在包装细胞RNA时分子运动更剧烈,且在组装的过程形成较多无法进行高效组装的小聚落中间体(assembly intermediates)。基于这些结果,课题组提出以下的组装模型:二聚体gRNA(长度约18 kb)可以作为长链的支架协同驱动Gag发生多聚化,形成紧密的蛋白聚落,而由细胞RNA驱动的组装需要Gag在多条相对较短的细胞RNA上分别多聚化形成小聚落中间体,再由小聚落发生进一步聚集形成更大的复合物,因此组装的协同性低,蛋白聚落更加松散。最后,课题组还发现较松散的VLP组装过程能够使得跨膜蛋白如MLV-Env在HIV病毒包膜的富集水平更高,提出了跨膜蛋白在病毒颗粒上的富集能够受到Gag组装造成的空间位阻调控的概念(图2)。
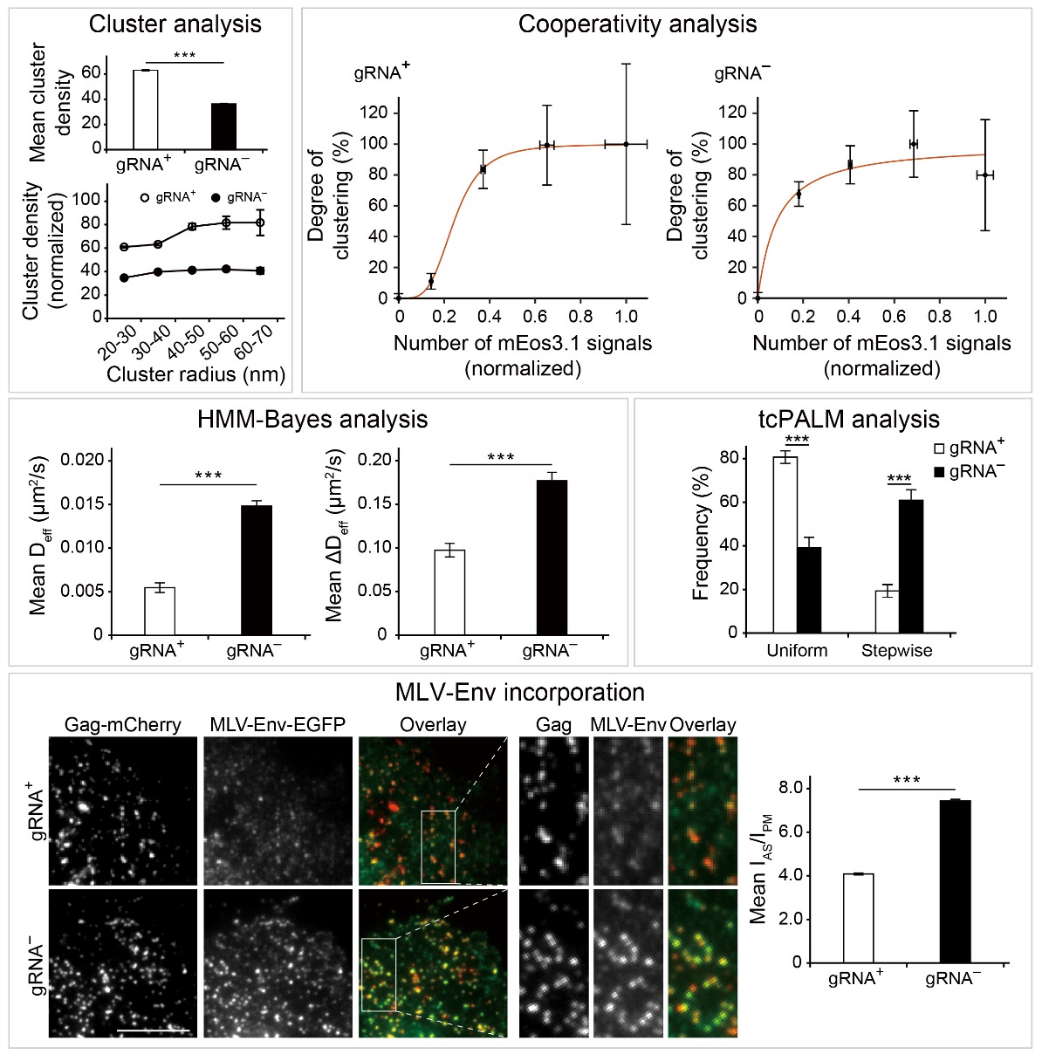
图1. Gag在细胞膜上以病毒RNA(gRNA+)或细胞mRNA(gRNA-)作为支架进行组装及其后续招募跨膜蛋白的能力的比较
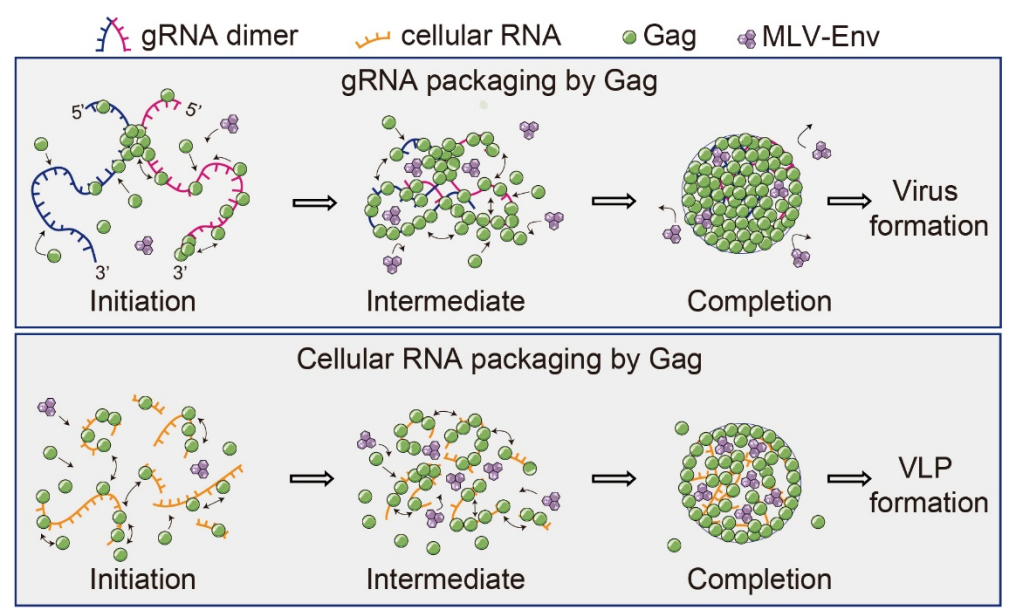
图2. Gag在细胞膜上以病毒RNA或细胞mRNA作为支架进行组装及招募跨膜蛋白的示意图
这项研究对于开发基于HIV VLP包装以病毒或非病毒跨膜蛋白为抗原的工程化疫苗开发具有重要意义。例如,与传统的减毒活疫苗和灭活疫苗相比,基于VLP的疫苗除了具有更高的安全性和更易制造等优势外,还能容纳更多的(跨膜蛋白)抗原,因此可能提供更强的治疗效力。目前课题组正在基于这项研究发展基于VLP的新型RNA递送技术与疫苗平台技术。
北京大学未来技术学院陈匡时课题组博士研究生应亚宸为本文第一作者。课题组已毕业博士杨艳涛参与了本文前期工作。陈匡时研究员为本文的通讯作者。本工作得到了国家重点研发计划和国家自然科学基金的支持。




