Neurophotonics | 吴润龙课题组开发了宽视场荧光导航系统,赋能自由行为动物高效多光子成像
信息来源:吴润龙教授课题组
荧光成像技术,包括单光子(1P)、双光子(2P)和三光子(3P)显微镜技术,极大的推动了神经科学的发展。特别是微型化荧光显微镜的出现,开启了自由活动动物中神经元结构和活动观察的新范式。微型化双光子(m2PM)与三光子显微镜(m3PM)在自由活动动物成像中扮演着日益重要的角色[1-5],然而,其实践应用仍面临诸多挑战。多光子显微镜优异的光学切片能力导致其景深较浅(3至20µm,由轴向分辨率确定),成像视野通常在1mm2以内。在缺乏引导的情况下,要在跨越数毫米颅窗或梯度变折射率透镜(GRIN Lens)的三维空间中,快速定位目标感兴趣区域(ROI)仍具挑战性。尤其是对于缺乏经验的研究者而言,确认ROI并将微型化显微镜安装到小鼠头部可能耗费数十分钟甚至数小时,这极大限制了该技术在自由活动动物研究中的进一步应用。
为解决这一问题,开发团队在早期的工作中将宽场(WF)物镜与m2PM头戴式装置的微型化物镜(FHIRM-TPM)相结合,创建了用于定位的宽视场荧光成像装置[1]。然而,由于早期的微型化物镜的视场有限(约150µm),在几毫米宽的颅窗内仍难以快速找寻感兴趣区域。此外,在切换至m2PM成像时,由于宽视场物镜的工作距离有限(约37.5mm),需要对光纤进行较大的弯曲,这使得操作更具挑战性。近期,Zong等人[5]引入了旋转台来固定m2PM头戴装置,通过角度调整实现与某些特定的脑区更好的对准。尽管取得这些进展,但在三维脑组织中快速定位感兴趣区仍存在挑战,给新研究人员带来了陡峭的学习曲线。此外,当前m2/3PM的工作距离小于2mm,当使用z轴平台定位焦平面时,样本或物镜极易受损,对经验不足的用户尤为明显。总的来说,亟需开发一种具有增强引导功能的多模态成像平台,并建立标准化工作流程,以实现对自由活动动物的高效成像。
多模态荧光成像平台的系统设计
为解决这一问题,开发团队设计了多模态荧光成像平台,将宽场荧光导航系统(WF-Nav)与微型化双光子显微成像和微型化三光子显微成像进行了整合(图1)。为充分发挥单光子激发的优势,WF-Nav系统配备了大视场和单细胞分辨率功能,可快速识别指定感兴趣区域。一旦定位到目标区域,系统可无缝切换至双光子或三光子成像,进一步实现高信噪比或深层神经元成像。随后将m2PM或m3PM探头固定于小鼠头部,释放小鼠进行自由活动成像。
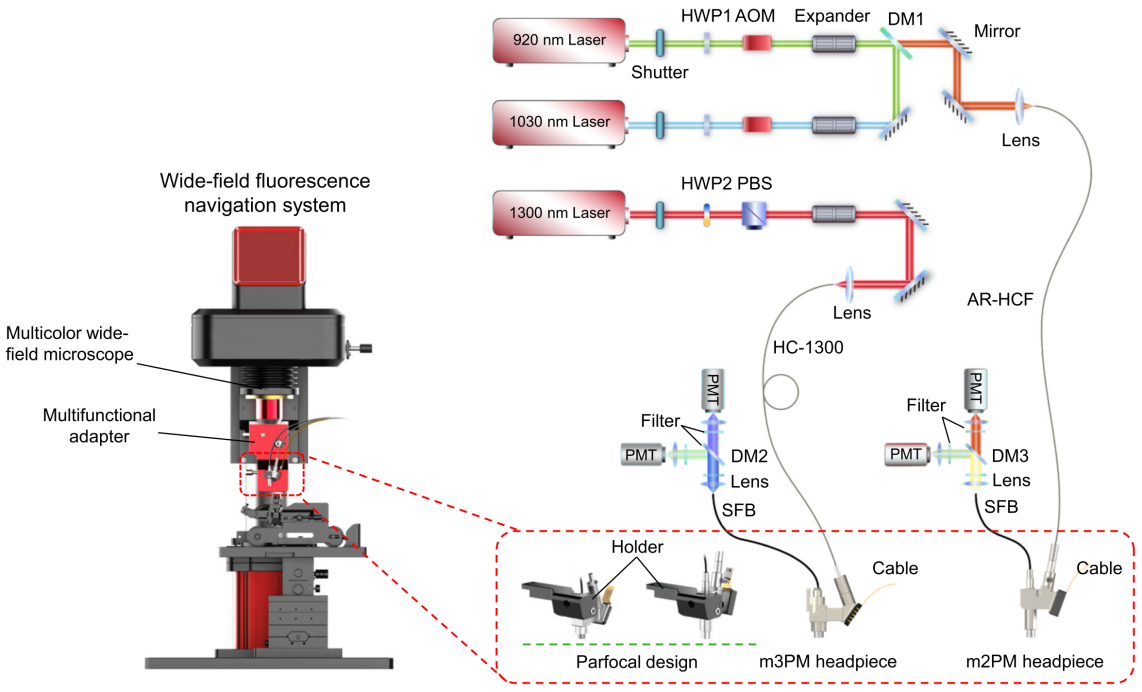
图1 多模态荧光成像系统设计
宽场荧光导航系统设计
WF-Nav系统由一台多色大视场宽场显微镜和多功能适配器组成(图2a1-a3)。该系统采用三个LED作为激发光源(405nm,473nm,561nm),并配备高数值孔径的非球面聚光透镜对LED光束进行准直,每个激发光路均配有相应的滤光片组。为实现大视场导航并为无缝切换多光子镜组提供充足空间,开发团队设计了一款长工作距离、低倍率的干式物镜。该物镜(3.3x)采用反远摄设计:前组为两片胶合双合透镜提供负光焦度,后组由单片球面透镜构成(图2b)。这种结构将主平面后移以校正色差,在保持数值孔径的同时实现了超长有效焦距的工作距离,最终达成90mm工作距离的突破性指标,并实现了Φ5.64mm的最大成像视场。
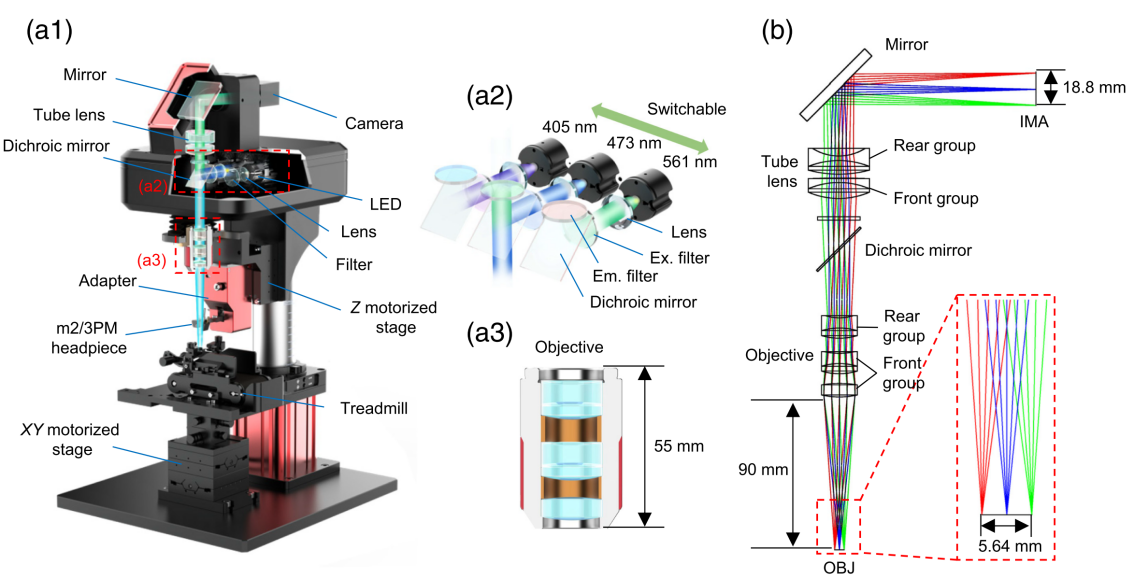
图2 宽场荧光显微镜设计
为实现宽场模式与多光子成像模式间的无缝切换,该团队设计了一款多功能适配器。该适配器连接宽场物镜,并在Z轴电动平台上进行焦距调节。通过标准化的m2/3PM探头设计,探头可稳固的安装在同一支架上,并保证了多光子与宽场模式切换时的齐焦成像(图3a-e)。
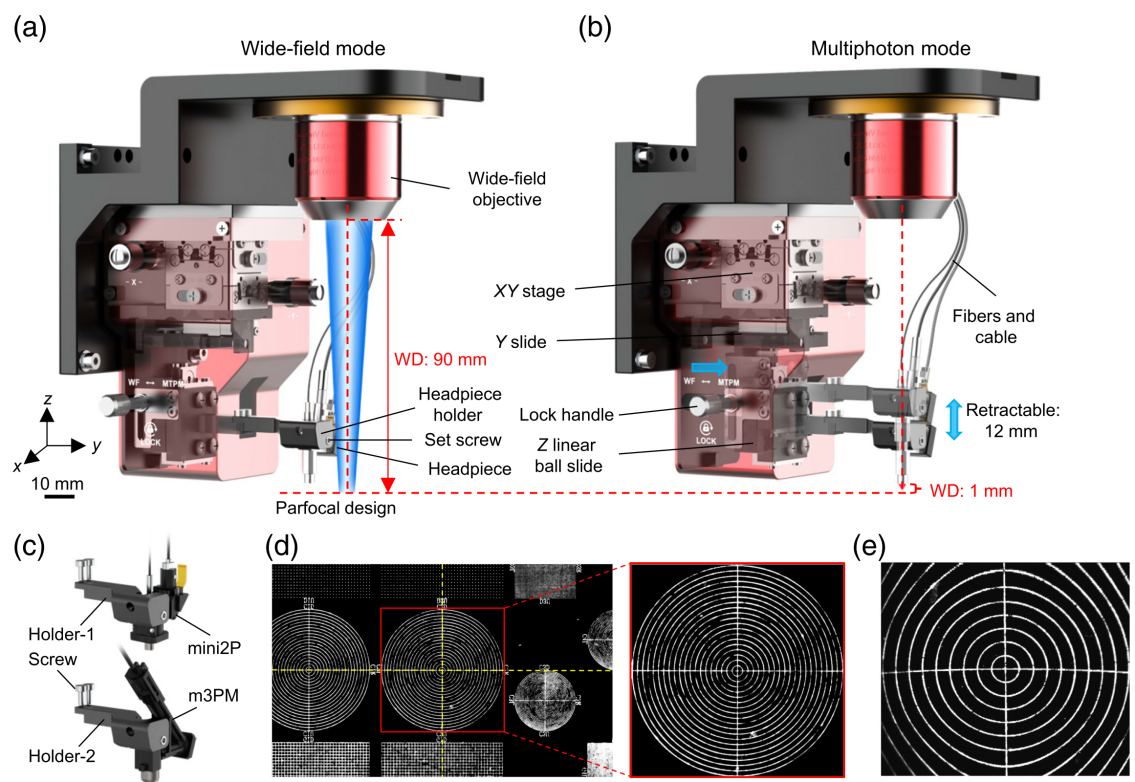
图3 多功能适配器与齐焦功能
此款90mm工作距离的物镜为操作头件、光纤或加装可拆卸电动变焦透镜模块提供了充足空间。头件支架安装在滑动阻力极小(约0.1N)、伸缩距离12 mm的轻型直线滚珠滑轨上,可有效避免物镜与样本的碰撞风险。通过更换头件支架,系统可兼容不同头件,如mini2P和m3PM。此外,得益于微型化化双光子显微镜的尺寸与可回缩设计,相较于常规台式物镜,该系统在大多数方向上提供了更大的观察角度,从而带来了更广的样本观察范围。这一设计显著提升了样本的粗定位效率。
接下来,开发人员评估了宽场荧光显微镜的光学性能与实际应用。对Thy1-YFPH小鼠的脑切片进行成像,可以清晰识别出神经元和轴突(图4c)。在470nm波长下进行活体钙离子成像,561nm波长下进行形态学成像,成功捕获了3804个GCaMP6f标记的神经元(图4d)以及4650个表达mCherry的小鼠星形胶质细胞(图4e)。这些结果证明了该宽场显微镜具备多色、单细胞分辨率和高通量成像能力,并提供了对感兴趣目标区域导航的出色性能。
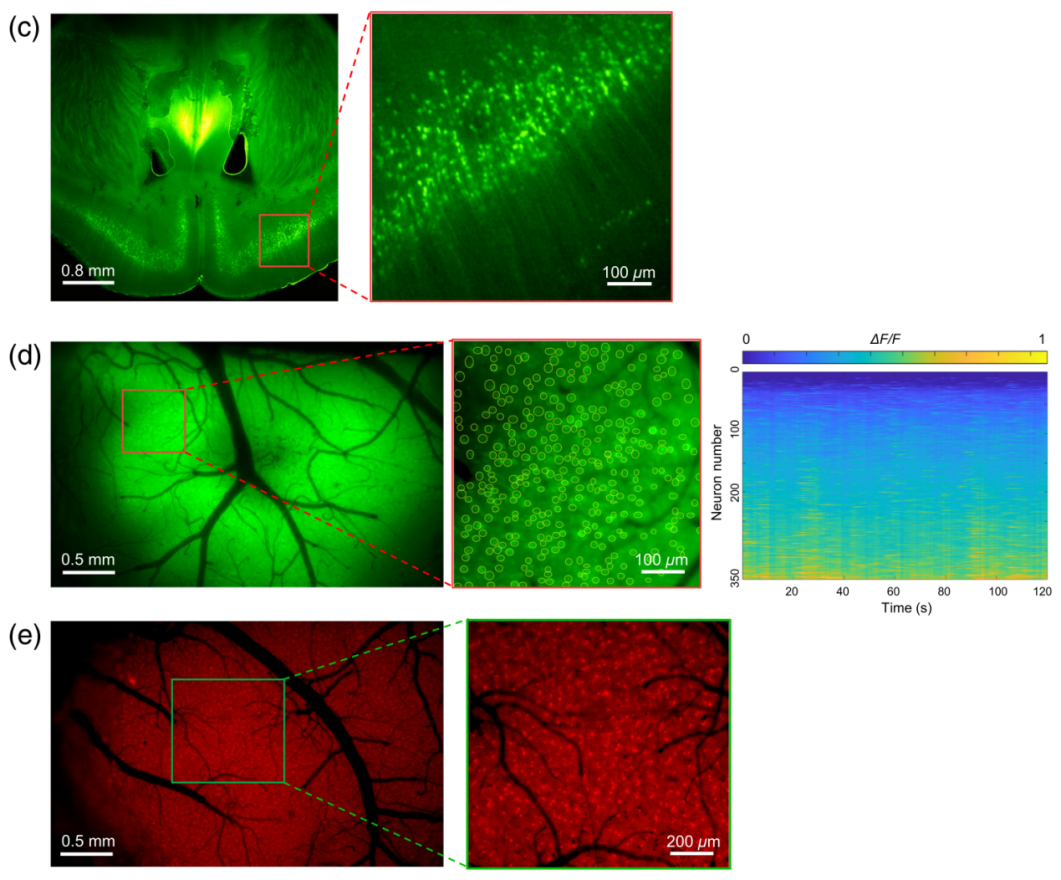
图4 微型化宽场显微镜高通量成像
标准化微型多光子显微成像流程建立
为了让自由活动小鼠中的m2PM成像工作更加顺畅,开发人员建立了一套标准化成像流程(图5a),以提高自由活动动物中m2PM成像的效率。首先对动物进行病毒注射和外科手术操作,如颅窗植入或GRIN Lens植入,随后等待2-4周确保病毒充分表达及手术损伤恢复。以某次实验为例,开发人员在初级运动皮层(M1)神经元中标记了GCaMP6s和mCherry,随后将小鼠固定于WF-Nav装置下的跑步机上(图5b)。接着通过宽场显微镜定位目标感兴趣区域并将其对准视野中心(图5c)。随后通过适配器切换至m2PM模式(图5d),在920nm和1030nm波长下进行双色双光子成像,最后对XY轴和焦平面进行精细调整(图5e, f),可以在几分钟内确认最终的目标区域。大多数情况下,会将目标焦平面抬高约25µm,以补偿水泥收缩导致的焦点偏移,再将Baseplate固定在动物头部的头件上,经过约10分钟的固化后,小鼠即可进行自由活动成像(图5g)。
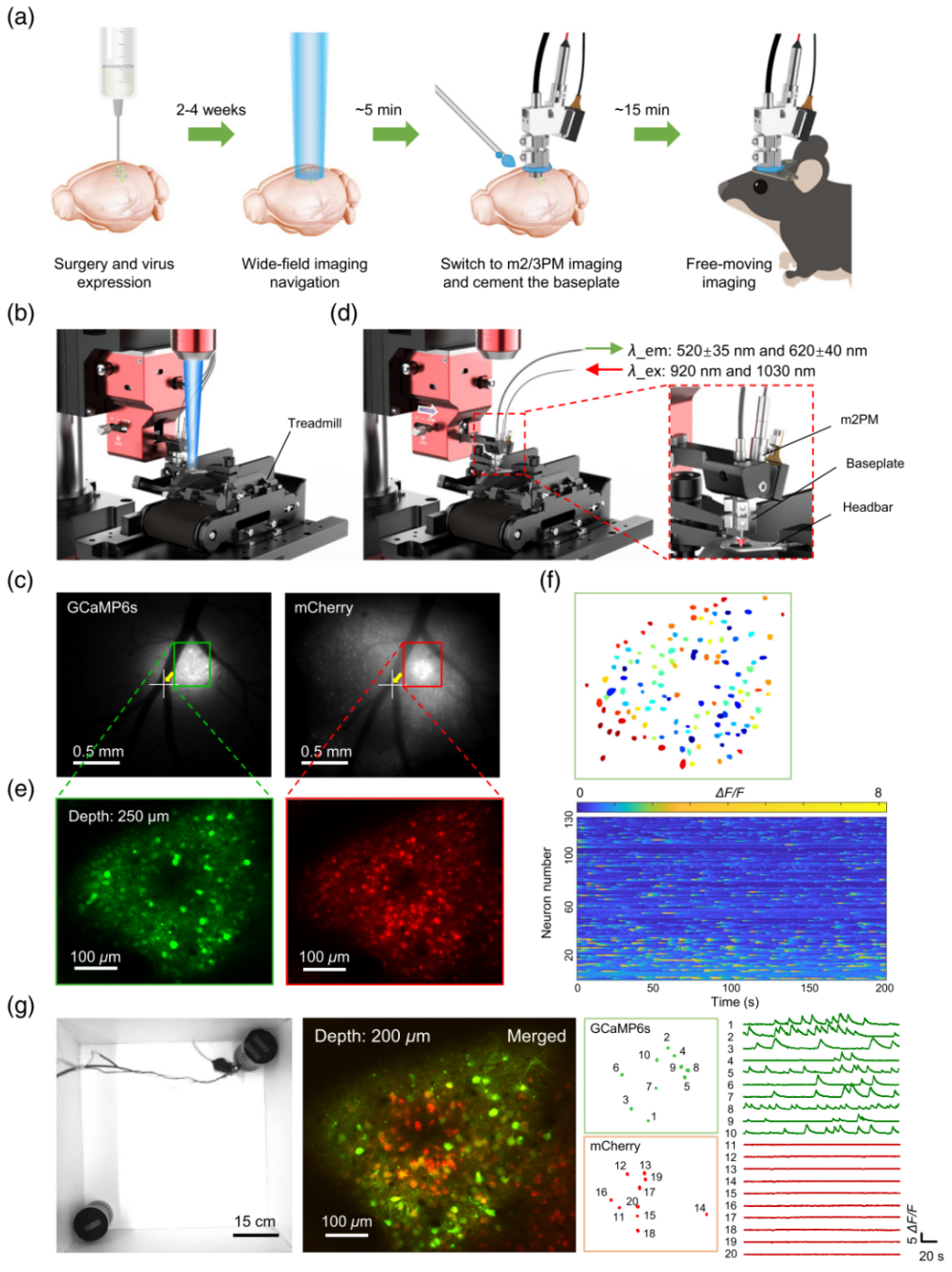
图5 标准化自由活动微型双光子显微成像流程
开发人员通过小鼠社交实验中对神经元的钙信号和结构进行成像,验证了该系统,整个安装操作过程耗时约20分钟,成功率高达100%(n=15),即使是没有经验的研究人员也能轻松掌握,从而极大地提高了实验效率。
北京信息科技大学、生物医学成像北京实验室吴润龙教授为本论文的第一作者和通讯作者。北京大学生物医学成像科学中心、生物医学成像北京实验室程和平教授、王爱民副教授、赵春竹助理研究员,北京航空航天大学、生物医学成像北京实验室冯丽爽教授共同参与了该项研究工作。吴润龙课题组硕士生孙玉昆、郝泽宇为本工作做出了重要贡献。该项目得到了北京大学分子医学南京转化研究院和北京超维景生物科技有限公司的技术支持。
全文链接:Wu R, Sun Y, Hao Z, et al. Wide-field fluorescence navigation system for efficient miniature multiphoton imaging in freely behaving animals.Neurophotonics. 2025;12(2):025018. doi:10.1117/1.NPh.12.2.025018
https://doi.org/10.1117/1.NPh.12.2.025018
【参考文献】
[1]Zong, W. et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature methods 14, 713-719 (2017).
[2]Zong, W. et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nature methods 18, 46-49 (2021).
[3]Wu, R. et al. A versatile miniature two-photon microscope enabling multicolor deep-brain imaging. bioRxiv, 2025.2002.2013.635171 (2025).
[4]Zhao, C. et al. Miniature three-photon microscopy maximized for scattered fluorescence collection. Nature Methods 20, 617-622 (2023).
[5]Zong, W. et al. Large-scale two-photon calcium imaging in freely moving mice. Cell 185, 1240-1256. e1230 (2022).




