Science|北大李毓龙团队开发远红光多巴胺探针,观测脑内神经递质“多色共舞”
信息来源:李毓龙教授团队
作为自然界最复杂的结构之一,人脑是一个由近千亿个神经元和数万亿个神经突触交织构成的高度精密的“生物宇宙”。在这片神经星海中,数以百计的神经递质如同永不停歇的化学信使,调控着我们的思维、记忆、情绪与行为。其中,多巴胺(dopamine,DA)作为调控奖赏、运动与学习等脑功能的“快乐分子”,常常与乙酰胆碱、内源性大麻素、五羟色胺等其它神经递质密切协同或彼此制衡;此外,多巴胺的功能还依赖于胞内信号分子如cAMP、Ca2+等在不同时空尺度下的精准调控。这些神经递质和胞内信号分子共同构成了一个高度动态、精密耦合的神经化学调控网络。近年来,领域内虽已开发出检测单种或两种神经递质的工具,却始终难以突破一个技术瓶颈——如何在活体动物脑中同步观测多种神经化学分子的实时变化?
2025年6月5日,北京大学李毓龙实验室联合国内外多个团队,在 Science 杂志在线发表了题为 In vivo multiplex imaging of dynamic neurochemical networks with designed far-red dopamine sensors 的研究论文,报道了基于化学遗传型策略的远红光多巴胺荧光探针及其应用。该探针能够与现有绿色和红色荧光探针搭配,在体外培养细胞、急性脑片、斑马鱼及活体小鼠中实现三色成像或记录,为多种神经递质的同时成像提供了强大工具。

【化学遗传策略助力探针光谱拓展】
开发远红或近红外神经递质探针的最大挑战之一是缺乏合适的荧光模块。目前已报道的远红或近红外荧光蛋白普遍亮度较低,且难以进行循环重排,制约了远红和近红外探针的开发和应用。为了突破这一局限,李毓龙团队利用亮度较高的远红荧光染料以及循环重排的自我标记蛋白HaloTag作为荧光报告模块,将其与G蛋白偶联受体激活(GRAB)策略巧妙结合,通过两千多个突变体的层层筛选,成功开发了远红光多巴胺探针GRABHaloDA1.0(简称为HaloDA1.0)。
在体外培养细胞系与原代培养神经元中,远红染料JF646标记的HaloDA1.0探针对多巴胺的荧光响应幅度可达到900%,表观亲和力为150 nM。HaloDA1.0探针具有亚秒级动力学、较好的膜定位和分子特异性,并且不与下游信号通路偶联。此外,该探针还可以与多种染料兼容,展现不同的颜色、反应幅度和亲和力,增强了不同场景使用的兼容性。
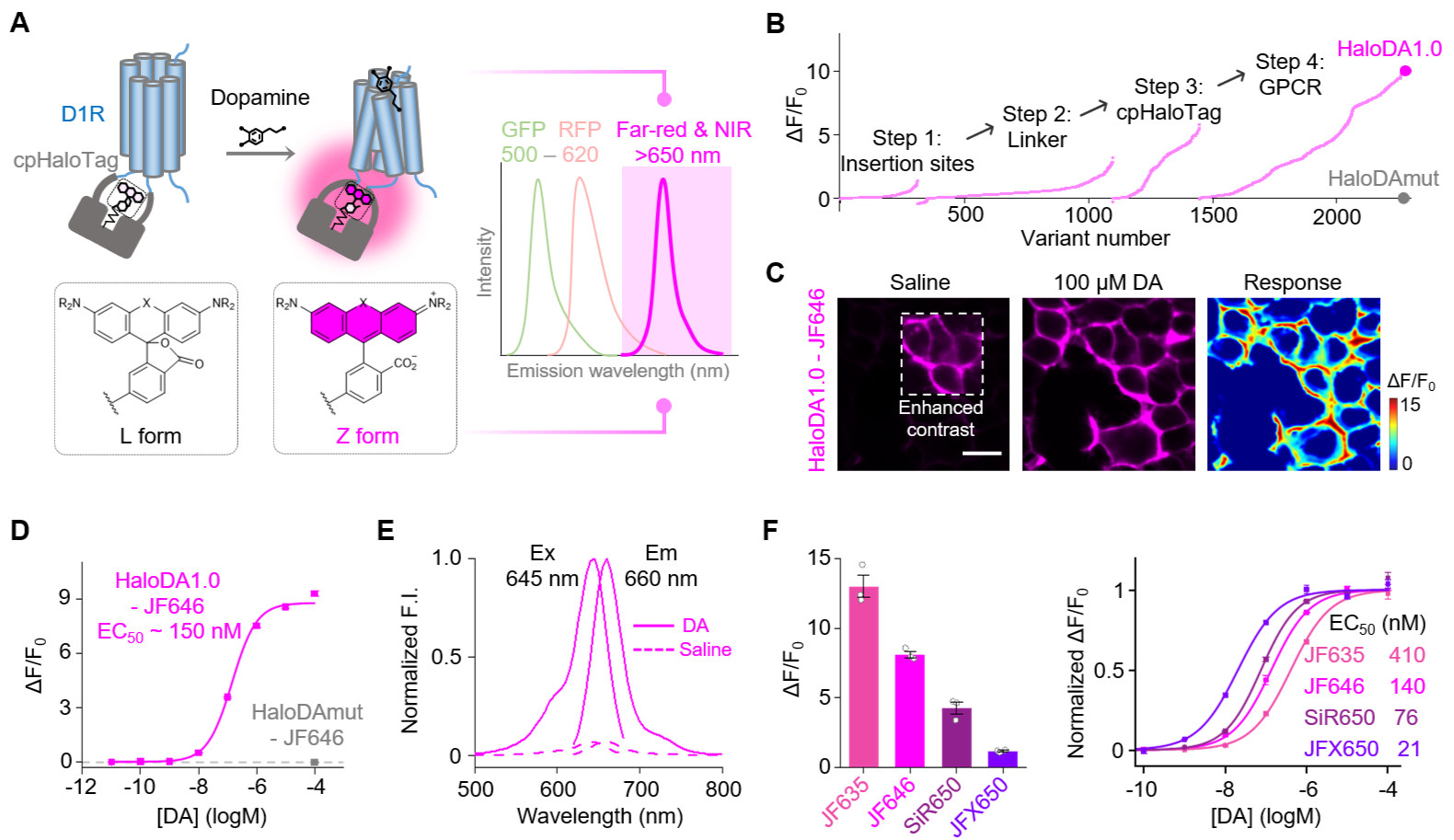
远红多巴胺探针的开发和刻画
【多系统三色成像看清神经递质“共舞”】
在体外培养的神经元中:HaloDA1.0探针与绿色去甲肾上腺素探针、红色五羟色胺探针共表达。在三色成像过程中,三种单胺类神经递质探针只对各自的激动剂和拮抗剂响应,不会发生串光干扰。
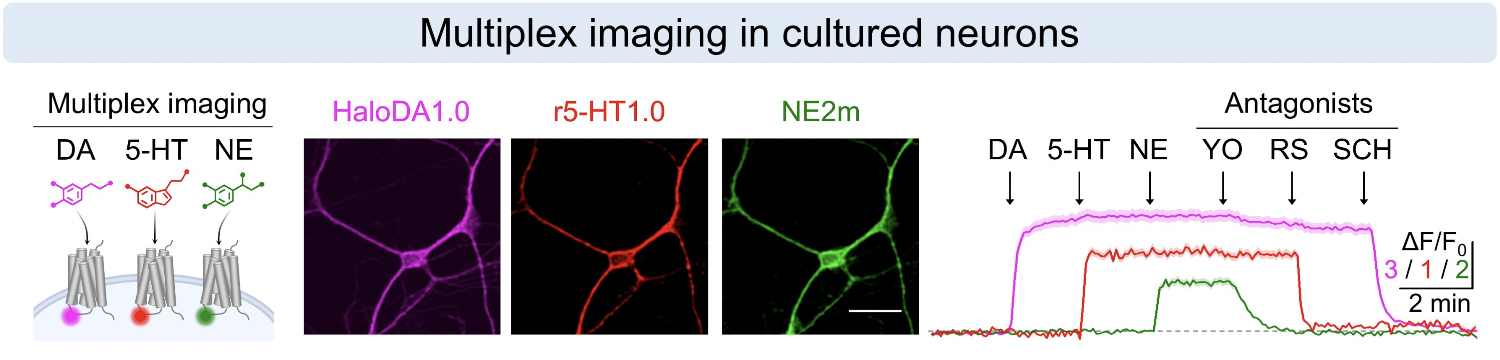
HaloDA1.0在体外培养神经元中进行三色成像
在急性脑片中:同时表达HaloDA1.0探针和另外两种绿色和红色神经递质探针,能够灵敏报告电刺激引起的多巴胺、乙酰胆碱和内源性大麻素的内源动态变化,揭示了三者差异化的释放动力学特征。结合药理学处理实验,研究人员深入探究了三种神经递质之间的调控关系。
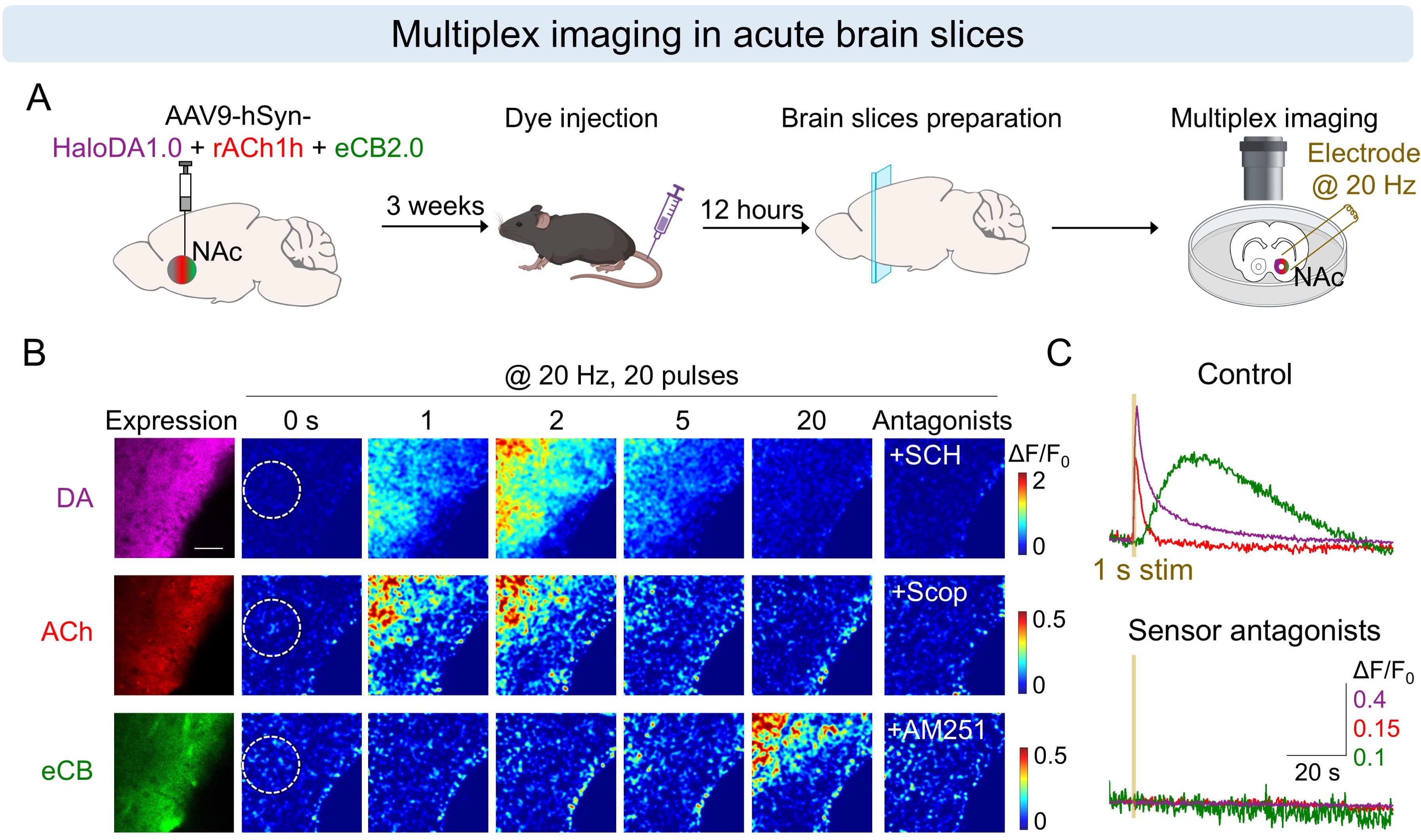
HaloDA1.0在急性脑片中进行三色成像
在斑马鱼中:通过与中国科学院脑科学与智能技术卓越创新中心穆宇老师合作,团队构建了同时表达绿色ATP探针、红色钙探针和远红HaloDA1.0探针的转基因斑马鱼。结合三色成像,研究人员在斑马鱼电击刺激和癫痫样行为过程中,实时观察到多巴胺、胞外ATP及神经元钙信号呈现同步化的释放或活动,并且三者在信号消退阶段表现出不同的下降速率。
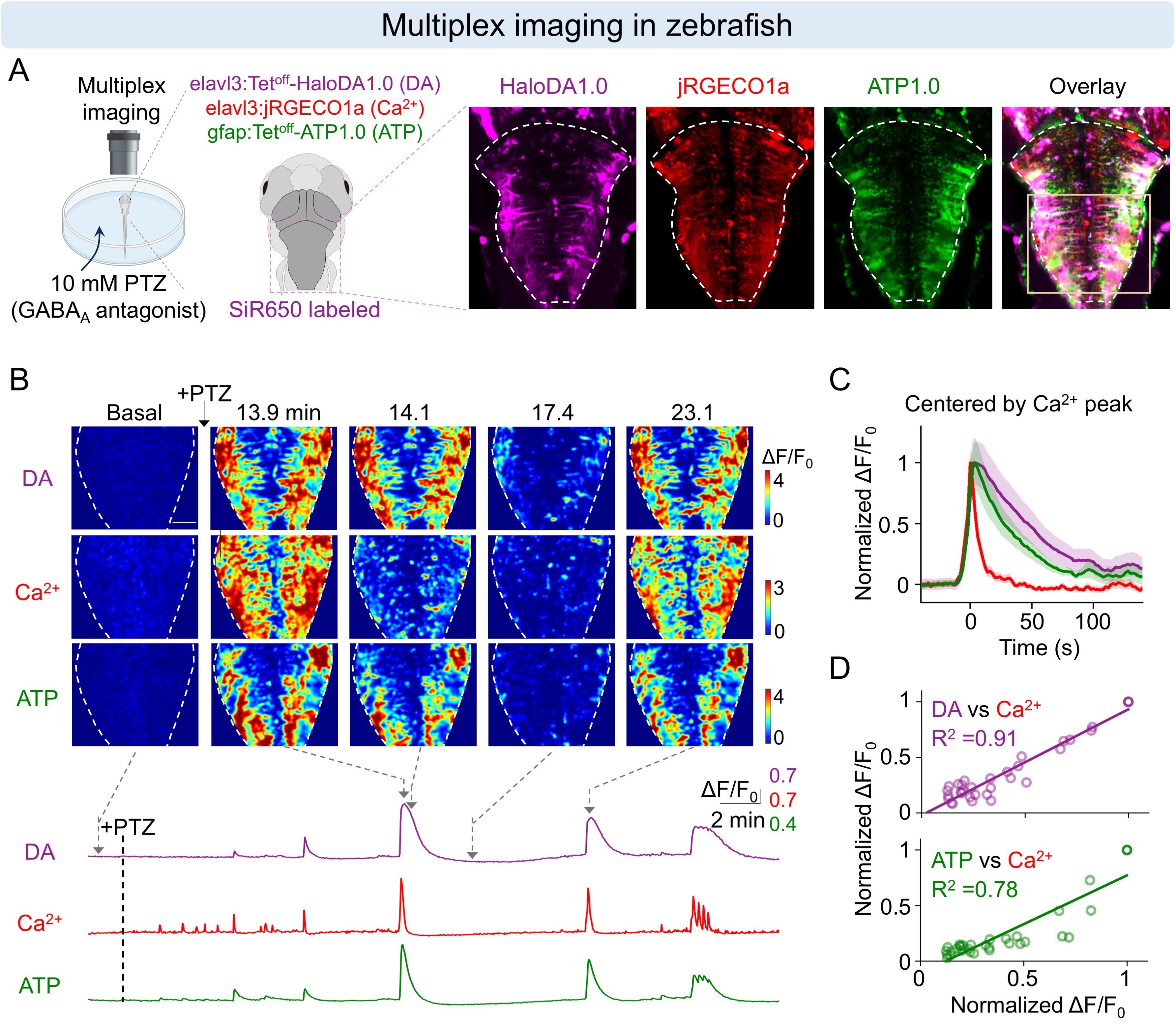
HaloDA1.0在斑马鱼中进行三色成像
【活体小鼠中解码神经信号调控规律】
与基于荧光蛋白的探针相比,化学遗传型探针在活体小鼠中应用的关键挑战是如何将染料高效递送入脑。为了解决这一难题,本研究结合光遗传学范式进行活体筛选,寻找兼具优异荧光响应与良好血脑屏障通透性的远红染料。结果显示,SiR650标记的HaloDA1.0探针可以在多巴胺能神经元投射丰富的伏隔核和投射稀少的大脑皮层,均能特异性检测光遗传激活多巴胺神经元引起的多巴胺释放。此外,借助HaloDA1.0的远红波长优势,研究人员在中央杏仁核实现了蓝光激活多巴胺能神经元的同时,双色记录多巴胺探针与红色钙探针的信号,并结合药理学揭示了多巴胺对下游神经元钙活动的调控作用。
进一步地,本研究开展了三色光纤记录,实现在小鼠自发活动、糖水奖赏、足部电击和可卡因注射条件下,同步记录伏隔核内多巴胺、乙酰胆碱及D1中型多棘神经元胞内cAMP的动态变化。结果显示,生理行为中多巴胺与乙酰胆碱协同调控cAMP,而可卡因刺激下两者呈拮抗效应。上述结果为理解神经化学分子的调控机制提供了新视角。
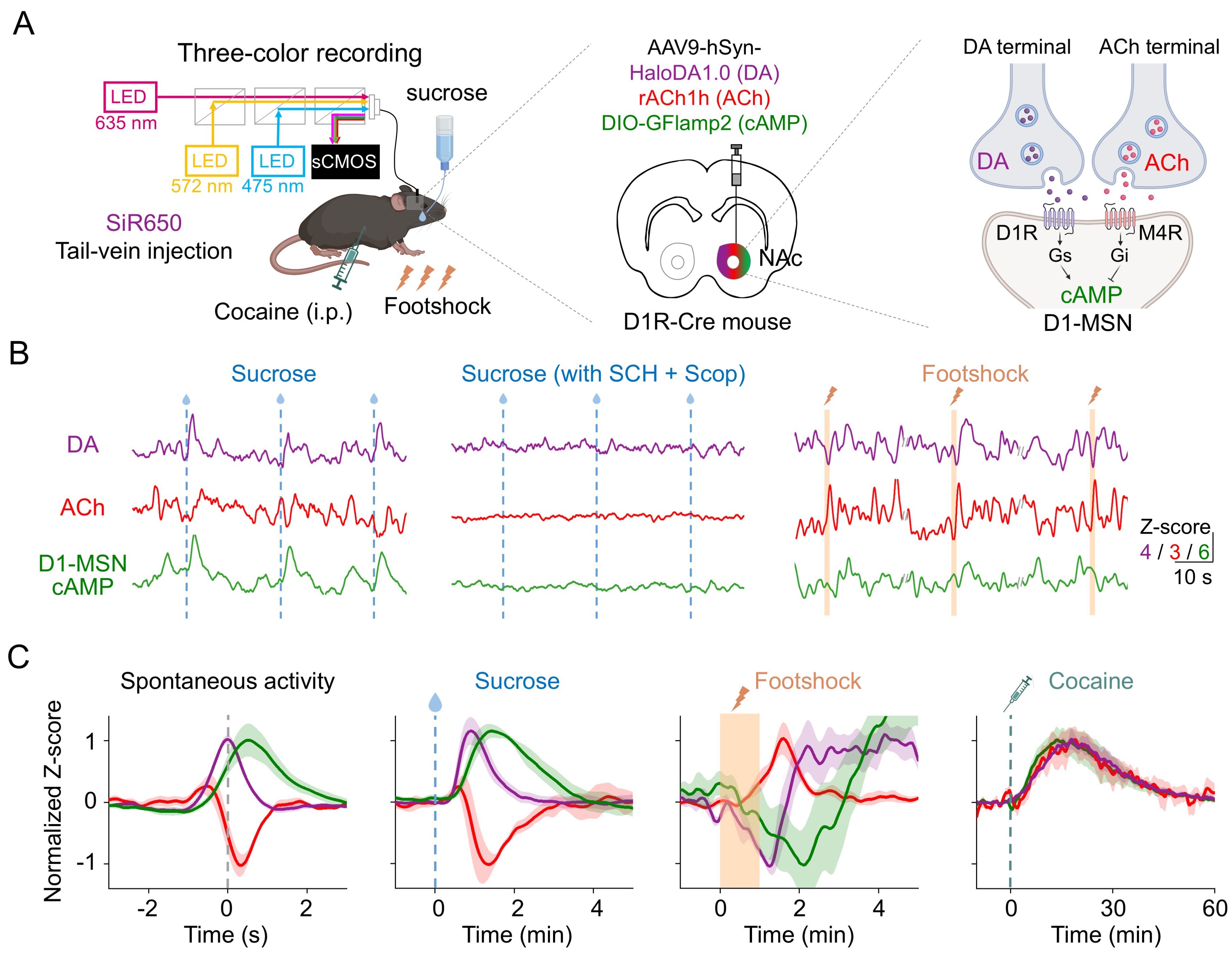
运用在体三色光纤记录揭示小鼠伏隔核神经化学分子的动态和调控关系
综上所述,李毓龙课题组拓展了多巴胺探针的光谱,成功开发了远红光的多巴胺探针HaloDA1.0。这一新型探针可在细胞、脑片、斑马鱼及小鼠多系统中,灵敏且特异地报告多巴胺的动态变化。通过与绿色和红色荧光探针联合应用,HaloDA1.0让研究者得以同步捕捉多种神经化学分子的变化,深入解析它们的时空动态特征和调控关系。这项成果是跨学科合作的重要产物,既拓展了活体化学研究的边界,也为解析大脑复杂的神经递质调控网络提供了有力支持。
北京大学生命科学学院李毓龙教授为该论文通讯作者,北京大学生命科学联合中心博士生郑宇和生命科学学院博士生蔡儒仪为共同第一作者,神经所穆宇课题组王逵博士和北大陈知行课题组张钧维博士为共同第二作者。神经所穆宇研究员、北京大学陈知行研究员、美国Janelia研究所Luke Lavis和Eric Schreiter研究员、德国马普所Kai Johnsson教授共同参与了该项研究工作。李毓龙课题组卓一洲博士(现为美国俄勒冈健康与科学大学Vollum研究所博士后)、董辉博士(现为上海交通大学松江研究院青年研究员)、张雨琪(现为瑞士洛桑联邦理工学院博士生)、王依凡(现为美国纽约大学博士生)、邓飞博士(现为斯坦福大学博士后)、纪恩博士、崔艺文、黄海耘、李少创等对文章做出了重要贡献。
目前HaloDA1.0的病毒在维真和枢密公司有售,活体所需染料SiR650-HTL可以从南京浦海景珊公司购买,三色光纤系统可以从千奥星科或瑞沃德公司购买。
专家点评
张凡(复旦大学化学系教授):
多巴胺是我们大脑中一个非常重要的神经递质,几乎参与了所有与动机、奖赏、情绪甚至疾病相关的过程。如何在活体动物中实时、精准地观察多巴胺的动态变化,一直是神经科学研究中的核心挑战。近期李毓龙团队发表在Science上的这篇工作可谓在这一领域迈出了令人振奋的一步。
李毓龙团队在早期开发的GPCR激活型荧光传感器(GRAB)基础上,首次将HaloTag标签蛋白融合至多巴胺受体,并引入可特异性结合HaloTag的小分子染料,构建出模块化的HaloDA1.0传感器。通过多巴胺激活诱导的构象变化,成功实现了对多巴胺的高灵敏荧光响应。这种融合“化学”与“遗传学”的创新策略,可通过更换不同发射波长的染料,促进对多种神经递质或信号分子的多色成像。令人印象深刻的是,HaloDA1.0在小鼠模型中已实现多巴胺、乙酰胆碱(ACh)和环腺苷单磷酸(cAMP)的三色同步记录,记录质量可媲美甚至优于传统基因编码探针,这为探索神经信号之间的动态协同或拮抗作用提供了强大的工具。
对于化学生物学领域而言,这项工作提供了一个非常值得借鉴的思路。我们一直在发展面向深层活体成像的近红外(700-2000 nm)化学染料。这类染料相比可见光荧光探针,具有组织穿透能力强、背景信号低等优势,但长期以来缺乏可精准靶向的成像工具。HaloDA1.0为我们提供了一个重要的模板。未来可将近红外染料嵌入类似系统,将会推动近红外神经成像的发展。总之,HaloDA1.0不仅是一个优秀的多巴胺传感器,更为神经科学领域的化学生物交叉研究带来了广阔的探索空间。
王佐仁(中国科学院脑科学与智能技术卓越创新中心副主任,神经科学国家重点实验室副主任):
李毓龙教授团队最新开发的远红色多巴胺传感器HaloDA1.0,通过结合HaloTag蛋白与化学染料,实现了对多巴胺动态的高灵敏度、高时空分辨率监测,并兼容多色成像技术。这一突破填补了传统荧光传感器在光谱范围(>650 nm)上的技术空白,使科学家能够同时追踪多巴胺与其他神经递质(如乙酰胆碱、内源性大麻素)及细胞内信号分子的相互作用。HaloDA1.0的研发成功标志着神经传感技术的重大突破,其多色兼容性、高灵敏度及跨模型适用性为研究多巴胺在神经网络中的动态调控机制和理解奖赏、动机、学习等行为的神经机制提供了前所未有的工具,并将推动对帕金森病、成瘾、精神分裂症等疾病的分子机制研究。
传统荧光传感器(如GCaMP,Fura-2)多由欧美实验室主导。而李毓龙研究组坚持原始创新,创造性地通过独特的“受体-染料耦合”设计出了HaloDA1.0,打破了技术路径依赖,实现“从0到1”的突破,走出了一条中国式的创新之路。这一重要成果再次展现了中国在神经科学与化学交叉领域的创新能力。




