陈良怡团队开发胰岛组织成像技术解析胰岛素两相分泌的跨尺度调控机制
信息来源:陈良怡教授团队
2024年1月26日,北京大学陈良怡团队在Nature Metabolism杂志在线发表论文“Releasable β cells with tight Ca2+-exocytosis coupling dictate biphasic glucose-stimulated insulin secretion”。他们通过开发高时空分辨率的胰岛组织荧光成像技术和计算机辅助图像处理分析算法,对完整无损的胰岛进行跨尺度研究,发现胰岛内只有一小群β细胞在分泌胰岛素,称为可释放b细胞(Readily releasable b cells,RRbs)。RRbs细胞是胰岛内的功能性β细胞,主导了葡萄糖刺激的胰岛素两相分泌。RRbs细胞通过同步化分泌形成胰岛素第一相,持续分泌形成第二相,是胰岛组织水平的核心调控机制。RRbs细胞功能紊乱与糖尿病的发生发展密切相关。

葡萄糖刺激的胰岛素两相分泌(Biphasicglucose-stimulatedinsulinsecretion,GSIS)是指当血糖急剧上升时可以刺激胰岛素快速短暂的第一相分泌和缓慢持续的第二相分泌。上世纪60年代末人们就发现,胰岛素第一相分泌降低是β细胞功能受损的早期标志(PMID:11484070)。本世纪头十年,人们利用电生理学(膜片技术),分子生物学和全内反射荧光成像技术(Total Internal Reflection Fluorescence microscopy, TIRFM),基于单细胞的膜电容、囊泡空间位置、以及整体动物水平的分子敲除实验等多个维度的相关证据,提出β细胞内存在不同的胰岛素囊泡库,分别参与快速和慢速的胰岛素分泌(PMID:11390882)。这是目前公认的GSIS两相分泌机制。然而,此模型并未考虑胰岛水平不同β细胞的功能差异(PMID:29559510)以及其他胰岛内分泌细胞(如α和δ细胞)的调控作用(PMID:16461897)。因此,胰岛水平胰岛素分泌如何调控仍不清楚。而探究这一问题最大的挑战是缺乏技术手段检测胰岛组织内不同β细胞的胰岛素分泌。
陈良怡教授课题组长期从事高时空分辨率荧光成像技术开发,探究糖尿病进程中胰岛素分泌异常的机制。他们利用Zn2+与胰岛素共释放的特性,采用锌离子荧光染料选择性标记胰岛素融合囊泡,结合高速转盘共聚焦显微镜,发明可同时检测胰岛内不同β细胞胰岛素囊泡分泌的方法—“锌闪烁”。利用“锌闪烁”技术,作者在单个胰岛上观察到了几百上千个胰岛素囊泡分泌事件,定量分析这些分泌事件的时空分布,发现生理葡萄糖刺激下只有一小部分胰岛β细胞分泌胰岛素,大部分β细胞很少分泌(图1)。
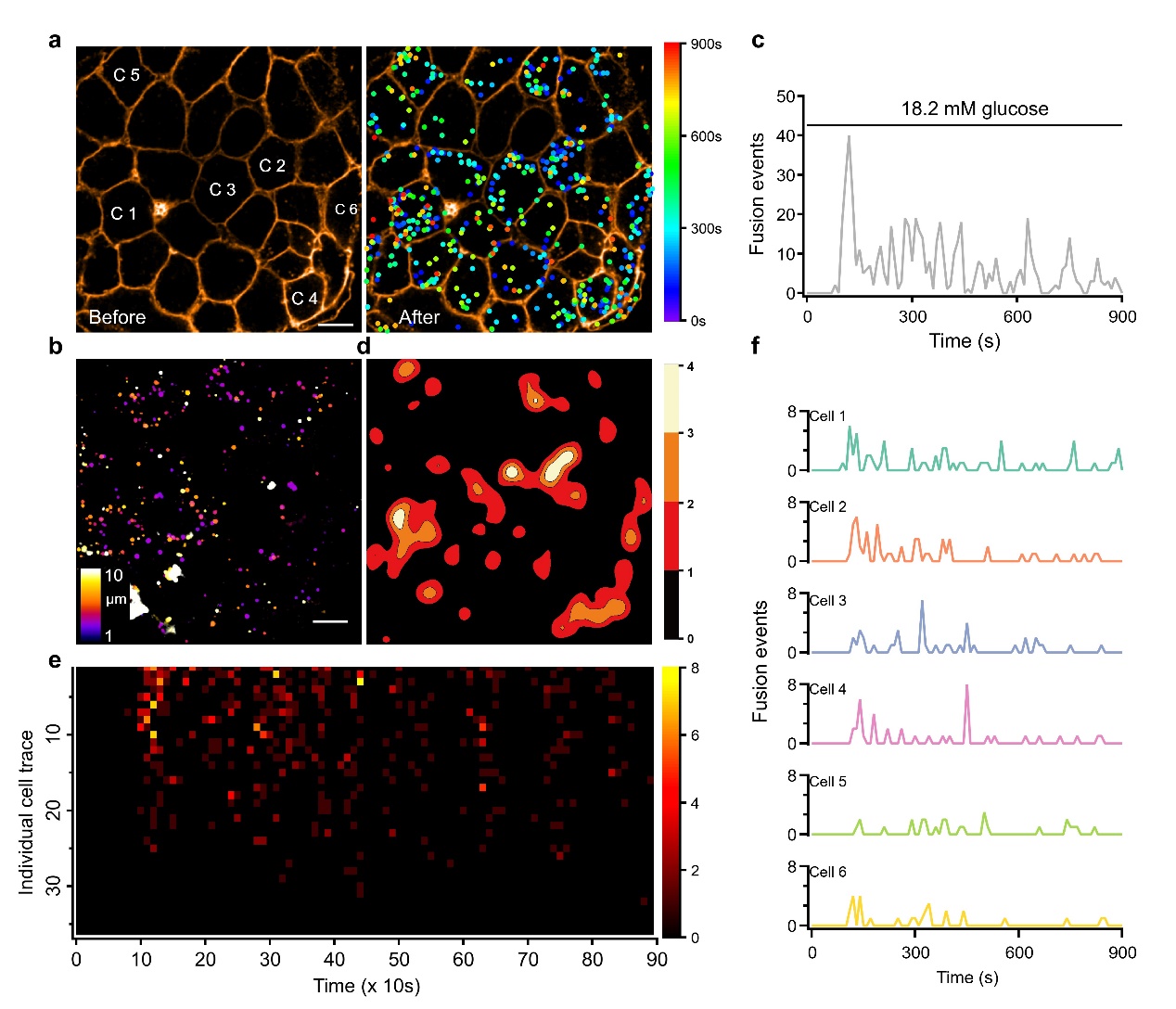
图1.葡萄糖刺激胰岛中异质性的胰岛素分泌。a, 18.2 mM葡萄糖刺激前后胰岛素囊泡分泌事件的时空分布图。点的位置显示分泌发生的地点,颜色代表时间。b, 分泌事件在三维空间中的分布。c, 胰岛素囊泡动态分泌过程。d, 分泌事件的等高线密度图。e, 单个胰岛细胞的分泌过程。一行代表一个细胞,一个像素代表10s内分泌的囊泡个数。f, 图a中选定的六个细胞分泌动态的详图。标尺为10微米。
通过一系列的数学测试,他们发现胰岛内β细胞的分泌能力呈指数分布。采用基尼系数定量评估这种异质性,表明大约40%的胰岛细胞贡献整个胰岛80%的分泌事件。因此,将这群分泌能力较强的b细胞定义为RRβs,其余不响应葡萄糖刺激分泌胰岛素的β细胞定义为Releasable-incompetent β cells (RIβs)。对同一个胰岛重复两轮相同葡萄糖刺激,RRβs重叠率高达83%,证明它们是胰岛中稳定存在的功能性β细胞。胰岛素两相分泌由RRβs所决定,它们的同步分泌形成快速第一相,而异步分泌产生慢速第二相。这表明胰岛β细胞通过某种超越其基本组成单位的集体行为才涌现出两相分泌的特征。
应用b细胞特异性表达Ca2+指示剂的小鼠模型Ins1-GCaMP6f小鼠和新型高性能锌离子探针PKZnR-1(PMID:34423531,北京大学陈知行团队合成),作者证明尽管RRβs与RIβs在分泌能力上相差数倍,但Ca2+信号并没有明显区别。这与近期报道的基于Ca2+信号特征分类的“高功能”b细胞亚群如Hub/Leadercells(PMID: 27452146;PMID: 32694805),1strespondercells(PMID: 36099294)等明显不同,这也表明Ca2+信号并不能够指代胰岛β细胞的功能。RRβs和RIβs的功能差异主要受Ca2+-分泌偶联效率影响,这种偶联效率是邻近的a细胞和d细胞共同作用的结果。
最后,作者探究了RRβs细胞在糖尿病发生发展中的作用。在瘦素缺失的ob/ob小鼠胰岛上,RRβs数目显著减少(4周龄50% vs 30%,8周龄42% vs 27%,图2a-2b)。而且ob/ob小鼠b细胞Ca2+信号从正常小鼠的Constant模式转变为Spike模式, 导致RRβs以“Burst”的形式来分泌胰岛素(图2c-2d)。这些现象表明在胰岛水平,RRβs是胰岛素分泌调控的核心,RRβs功能失调是胰岛功能紊乱的关键环节。
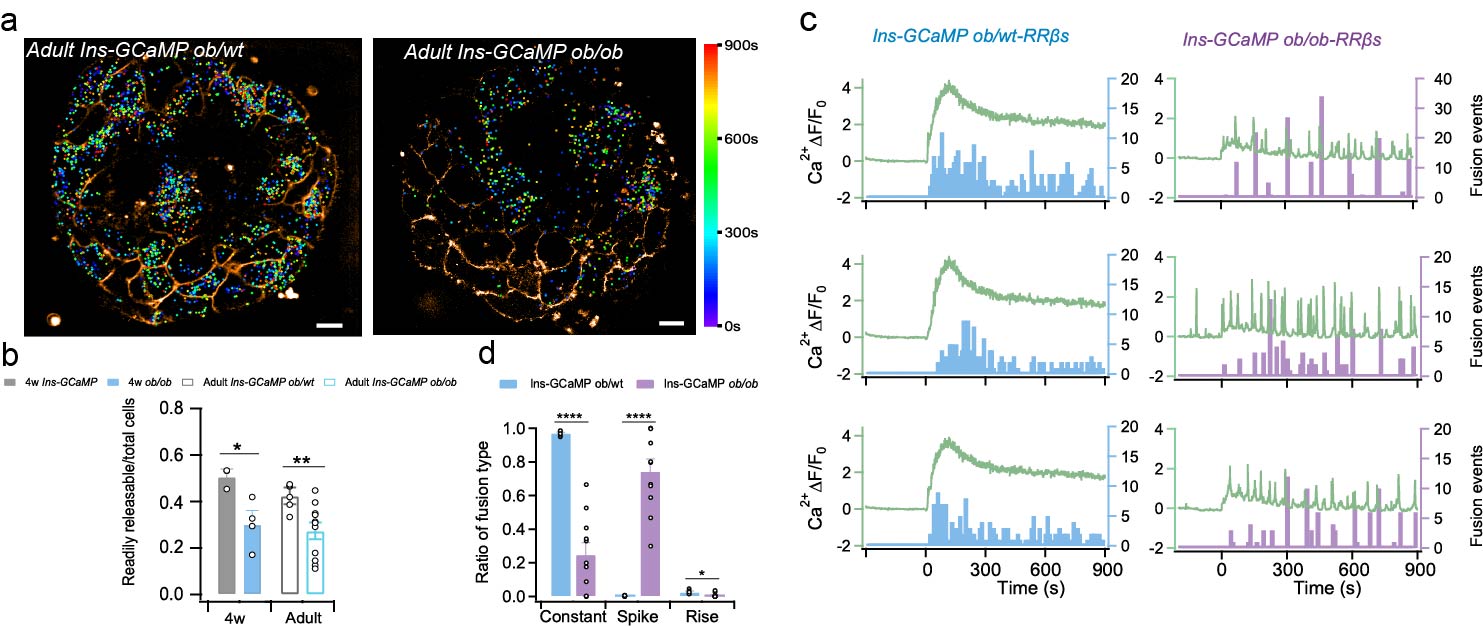
图2.ob/ob小鼠胰岛的异常胰岛素分泌。a,成年ob/ob小鼠及其同窝杂合子胰岛的胰岛素囊泡分泌时空分布。b, RRβs细胞在胰岛细胞中的比例。c, ob/ob小鼠及其同窝杂合子胰岛中RRβs细胞的钙信号(曲线)与胰岛素囊泡分泌事件(柱状图)的关系。d,不同钙信号触发的分泌事件比例。
总的来说,本研究通过跨尺度的胰岛组织成像技术鉴定了胰岛中功能性β细胞,RRβs细胞,从而回答了五十年来人们一直不清楚的机制:是RRβs细胞而不是每个胰岛b细胞中的囊泡库决定葡萄糖刺激的胰岛素两相分泌。这一研究成果也表明单个b细胞组织成一个完整胰岛时其个体的功能受到限制,从而涌现出胰岛组织水平固有的理化特性和调控机制。这种调控机理不可能被细胞水平上、分子操纵的实验所完全阐明清楚。因此,结合不同尺度上研究、发展在不同尺度上的高分辨率功能成像方法往往是找到生理和病理关键机制的必经之路。
该工作在线发表的同时,Nature Metabolism以Research Briefing的形式介绍了该工作(https://www.nature.com/articles/s42255-023-00964-y)。课题组还在Natureresearchcommunities发表了作者们跨越13年的背后故事“From a new method to a new mechanism: the Long March to understand how islet insulin secretion is regulated by glucose stimulation”(https://communities.springernature.com/posts/from-a-new-method-to-a-new-mechanism-the-long-march-to-understand-how-islet-insulin-secretion-is-regulated-by-glucose-stimulation)。
北京大学陈良怡教授和广州国家实验室刘会生研究员为本文共同通讯作者。北京大学彭晓红(原博士后,现为主管技师)、任会霞(博士后)、杨璐(助理研究员)、佟诗妍(毕业博士生)为本文共同第一作者。北京大学汤超院士、广州国家实验室徐涛院士、北京大学陈知行教授、西湖大学章永登教授为本研究提供了重要支持和帮助。本研究得到了新基石科学基金、国家杰出青年基金和国家重点研发计划基金等基金项目的支持。
原文链接:https://www.nature.com/articles/s42255-023-00962-0




